アミロイドβの線維形成が神経細胞膜上で加速するしくみ ~アルツハイマー病の解明に向けて~
自然科学研究機構(生命創成探究センター/分子科学研究所)の矢木真穂准教授(名古屋市立大学大学院薬学研究科 講師)、加藤晃一教授、西村勝之准教授は、同機構の奥村久士准教授、伊藤 暁助教、筑波大学の柳澤勝彦教授と共同で、神経細胞の表層にある糖脂質に結合したアミロイドβの構造を初めて明らかにしました。
本研究の成果は、国際科学雑誌 「ACS Chemical Neuroscience」(2023年7月23日付)に掲載されました。
本研究の成果は、国際科学雑誌 「ACS Chemical Neuroscience」(2023年7月23日付)に掲載されました。
- 雑誌名: ACS Chemical Neuroscience
- 論文名: The double-layered structure of amyloid-β assemblage on GM1-containing membranes catalytically promotes fibrillization
- 著者: Maho Yagi-Utsumi, Satoru G. Itoh, Hisashi Okumura, Katsuhiko Yanagisawa, Koichi Kato*, Katsuyuki Nishimura* (*責任著者)
- DOI: 10.1021/acschemneuro.3c00192
- 掲載URL: https://pubs.acs.org/doi/10.1021/acschemneuro.3c00192
発表のポイント
アルツハイマー病の原因物質であるアミロイドβタンパク質(Aβ)が神経細胞膜に存在する糖脂質であるGM1ガングリオシドに結合したかたちを調べたところ、Aβがこれまでに知られていないユニークなかたちをとって集まっていることがわかりました。さらに、この集合体は周囲のAβ分子に作用してそれらが線維化することを加速する“触媒場”としてはたらいていることを見出しました。この発見は、神経毒性を持つAβ線維の形成を加速する場を標的とする創薬の手がかりを与えることで、アルツハイマー病に対する新たな戦略を提供するものです。
研究の背景
アルツハイマー病は、Aβがアミロイド線維とよばれる異常な重合体を形成し、これが脳に蓄積することによって引き起こされることが知られています。Aβが線維形成をする分子機構を解明することは、医学・薬学の分野において非常に重要な課題となっています。Aβは、脳組織の神経細胞膜に存在する糖脂質であるGM1ガングリオシドに結合し、アミロイド線維の形成を促すことが報告されています。GM1ガングリオシドを含む膜に結合したAβを特異的に認識する抗体(抗GM1-Aβ抗体)が存在することから、こうした環境におかれたAβ分子は何らかの特別な構造を形成していると考えられています。しかし、その実体や線維形成を促進するメカニズムについてはこれまで明らかとなっていませんでした。
研究の成果
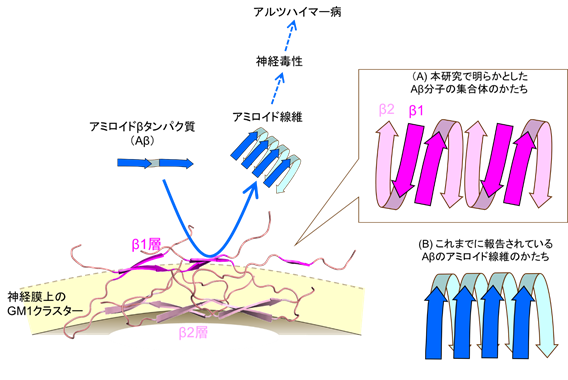
(図)(A)神経細胞膜上において、Aβ分子は「つ」の字型に折れ曲がった状態で、交互に向きを変えながら膜上に並んでおり、2つの層(膜から遠いβ1層と膜に近いβ2層)を形成している。このAβ集合体は周囲のAβ分子に作用してそれらが線維化することを加速する“触媒場”としてはたらく。(B)これまでに報告されているAβのアミロイド線維では、Aβ分子は同じ向きを向いて並んでいる。
研究グループは、固体核磁気共鳴分光法と分子動力学シミュレーションを用いて、GM1ガングリオシドを含む膜に結合した状態のAβ分子の3次元立体構造を決定しました。その結果、Aβ分子は「つ」の字型に折れ曲がった状態で、交互に向きを変えながら膜上に並んでおり、結果的に2つの層(膜から遠いβ1層と膜に近いβ2層)を形成していることが明らかになりました(図)。これまでに報告されているAβのアミロイド線維ではAβ分子は同じ向きを向いて並んでいることから、GM1ガングリオシドを含む膜上ではAβはこれとは全く異なるかたちの集合体を形成していることがわかりました。このユニークなAβ集合体はアミロイド線維に変化するのではなく、他のAβ分子がアミロイド線維を形成するのを助ける触媒として働くこともわかりました。この働きには膜表面で露出度の高いβ1層が密接に関わっていると推測されます。抗GM1-Aβ抗体はこの部分を特異的に認識していることも明らかになりました。
成果の意義および今後の展開
本研究では、神経細胞に含まれるGM1ガングリオシドを含む膜上において、アミロイド線維形成を促進する触媒となるAβの立体構造を明らかにすることができました。最近、Aβの重合体を標的とする様々な治療用抗体が開発されていますが、これらの抗体はアミロイド線維やその前駆体に対して結合するものです。本研究で解き明かしたAβ集合体はそれらとは全く異なるかたちをしており、抗GM1-Aβ抗体はこうしたユニークな構造を認識して結合していることになります。本研究は、脳組織でアミロイド線維を紡ぎ出すプラットフォームの構造的実体をはじめて突き止めたものであり、その存在を検出することはアルツハイマー病の発症リスクを予測することにつながり、その働きを抑えることで病気の進行を抑える道を開くものと期待されます。本研究で明らかにしたAβ分子の立体構造はアルツハイマー病に対する新たな戦略を提供するものです。
用語解説
1.アミロイド線維
タンパク質が線維状に凝集してできた物質。Aβが凝集してできたアミロイド線維がアルツハイマー病の発症に関与していると言われている。
2.固体核磁気共鳴分光法
磁場中に置かれた原子核が固有の周波数の電磁波と共鳴する現象を核磁気共鳴という。この現象を用いて動きが制限された分子の構造などを調べる実験手法を固体核磁気共鳴分光法という。
3.分子動力学シミュレーション
原子や分子の配置から力を計算し、ニュートンの運動方程式を数値的に解くことで仮想的に原子や分子の運動をコンピューター上で再現する計算手法。
タンパク質が線維状に凝集してできた物質。Aβが凝集してできたアミロイド線維がアルツハイマー病の発症に関与していると言われている。
2.固体核磁気共鳴分光法
磁場中に置かれた原子核が固有の周波数の電磁波と共鳴する現象を核磁気共鳴という。この現象を用いて動きが制限された分子の構造などを調べる実験手法を固体核磁気共鳴分光法という。
3.分子動力学シミュレーション
原子や分子の配置から力を計算し、ニュートンの運動方程式を数値的に解くことで仮想的に原子や分子の運動をコンピューター上で再現する計算手法。
研究サポート
本研究は、科学研究費補助金(JP19K07041 矢木真穂、JP21K06040 伊藤暁、JP21K06118 奥村久士、JP16K05858、JP19K05552 西村勝之)、JST戦略的創造研究推進事業さきがけ(JPMJPR22AC 矢木真穂)、名古屋市立大学研究助成(2212008、2222004矢木真穂)、生命創成探究センター共同利用研究(22EXC338、23EXC305 柳澤勝彦)等の支援を受けて実施されました。また、本研究の計算は、自然科学研究機構岡崎共通研究施設計算科学研究センターにて実施しました(20-IMS-C155、21-IMS-C172、22-IMS-C186)。固体NMR測定は、文部科学省ナノテクノロジープラットフォームプログラム 「分子・物質合成 プラットフォーム」(JPMXP09S17MS1095、JPMXP09S18MS1055、JPMXP09S18MS1087、JPMXP09S19MS1049)の支援を受けて、分子科学研究所で実施されました。
発表者
矢木真穂(自然科学研究機構 生命創成探究センター/分子科学研究所、名古屋市立大学大学院薬学研究科)
伊藤 暁(自然科学研究機構 生命創成探究センター/分子科学研究所)
奥村久士(自然科学研究機構 生命創成探究センター/分子科学研究所)
柳澤勝彦(筑波大学、国立長寿医療センター研究所)
加藤晃一(自然科学研究機構 生命創成探究センター/分子科学研究所、名古屋市立大学大学院薬学研究科)
西村勝之(自然科学研究機構 分子科学研究所)
伊藤 暁(自然科学研究機構 生命創成探究センター/分子科学研究所)
奥村久士(自然科学研究機構 生命創成探究センター/分子科学研究所)
柳澤勝彦(筑波大学、国立長寿医療センター研究所)
加藤晃一(自然科学研究機構 生命創成探究センター/分子科学研究所、名古屋市立大学大学院薬学研究科)
西村勝之(自然科学研究機構 分子科学研究所)