米国での希少疾患に関する研究開発環境の変化により、希少疾患薬のドラッグロスが拡大していることを示唆
研究成果の概要
世界には約7,000の希少疾患が存在しますが、95%の疾患では未だ有効な治療薬がなく、大きなアンメットメディカルニーズが存在しています。また、日本は海外で承認された薬剤が未開発・未承認という重大な社会問題、ドラッグロスに直面しています。
名古屋市立大学芸術工学研究科大学院生の塩谷和昭氏、同大学データサイエンス学部の児玉耕太教授らによる本研究では、希少疾患におけるドラッグロスの現状を分析し、日本におけるシームレスな開発に寄与する要因を検討しました。その結果、希少疾患のドラッグロスは近年急速に拡大し、主因は米国において希少疾患領域の研究開発(R&D)の主体が製薬企業からスタートアップ*1に遷移したこと、それに伴うR&D戦略の変化にあることが明らかとなりました。そして、ドラッグロス是正のためには日本企業の欧米のスタートアップとの早期からのパートナーシップ、国内エコシステムの構築を通じた創薬力の強化及び薬事規制の抜本的改革が重要であることが示唆されました。
名古屋市立大学芸術工学研究科大学院生の塩谷和昭氏、同大学データサイエンス学部の児玉耕太教授らによる本研究では、希少疾患におけるドラッグロスの現状を分析し、日本におけるシームレスな開発に寄与する要因を検討しました。その結果、希少疾患のドラッグロスは近年急速に拡大し、主因は米国において希少疾患領域の研究開発(R&D)の主体が製薬企業からスタートアップ*1に遷移したこと、それに伴うR&D戦略の変化にあることが明らかとなりました。そして、ドラッグロス是正のためには日本企業の欧米のスタートアップとの早期からのパートナーシップ、国内エコシステムの構築を通じた創薬力の強化及び薬事規制の抜本的改革が重要であることが示唆されました。
背景
希少疾患は、米国では罹患者数が20万人未満、日本では5万人未満の疾患と定義されます。個々の疾患の患者数は少ないものの、世界には約7,000の疾患が存在し、全人口の約5%に影響を及ぼしています。また、多くは生命を脅かし慢性的な衰弱をもたらします。一方、治療選択肢を有する希少疾患は5%未満であり、重大なアンメットメディカルニーズが存在しています。これには低い疾患認知度、高い開発難易度とコスト、低い収益性及び薬事・医療制度など様々な要因が関連しています。
希少疾患に対する薬剤開発を促進するため、これまでに様々な政策、規制措置及び技術等が導入されてきました。米国では1983年に、日本では1993年に希少疾病用医薬品(オーファンドラッグ)指定制度が導入され、開発者に種々のインセンティブを提供することで治療薬の研究開発を推進しています。2019年までに米国では5,000を超える薬剤がオーファン指定を受け、うち700超の薬剤が承認されています。また、日本では400を超える薬剤がオーファン指定を受け、300超が承認されています。
一方、日本は長年にわたり他国に比した薬剤承認の遅れ、ドラッグラグに直面し、公衆衛生に重大な影響を与えています。厚生労働省(MHLW)及び医薬品医療機器総合機構(PMDA)は規制対応等への取り組みを進め、ドラッグラグは徐々に減少してきています。しかしながら、希少疾患治療薬の開発には他剤にはない様々な障壁があり、状況が異なる可能性があります。実際、希少癌のドラッグラグは他の癌種に比して有意に長いことが指摘されています。また、米国で承認されたオーファンドラッグの50%以上は未だ日本で未承認との報告もあり、更に重大な問題、他国で承認された薬剤が日本で未開発・未承認というドラッグロスも示唆されています。さらに近年、米国で指定/承認されるオーファンドラッグが増加し、日本のそれと大きく乖離していることを踏まえると、ドラッグロスが拡大している可能性もあります。
そこで、本研究では、米国で承認されたオーファンドラッグの開発状況を分析し、希少疾患領域におけるドラッグロスの傾向及び関連因子、並びにR&Dモデルを検討し、日本におけるシームレスな薬剤開発に寄与する要因を同定することを目的としました。
希少疾患に対する薬剤開発を促進するため、これまでに様々な政策、規制措置及び技術等が導入されてきました。米国では1983年に、日本では1993年に希少疾病用医薬品(オーファンドラッグ)指定制度が導入され、開発者に種々のインセンティブを提供することで治療薬の研究開発を推進しています。2019年までに米国では5,000を超える薬剤がオーファン指定を受け、うち700超の薬剤が承認されています。また、日本では400を超える薬剤がオーファン指定を受け、300超が承認されています。
一方、日本は長年にわたり他国に比した薬剤承認の遅れ、ドラッグラグに直面し、公衆衛生に重大な影響を与えています。厚生労働省(MHLW)及び医薬品医療機器総合機構(PMDA)は規制対応等への取り組みを進め、ドラッグラグは徐々に減少してきています。しかしながら、希少疾患治療薬の開発には他剤にはない様々な障壁があり、状況が異なる可能性があります。実際、希少癌のドラッグラグは他の癌種に比して有意に長いことが指摘されています。また、米国で承認されたオーファンドラッグの50%以上は未だ日本で未承認との報告もあり、更に重大な問題、他国で承認された薬剤が日本で未開発・未承認というドラッグロスも示唆されています。さらに近年、米国で指定/承認されるオーファンドラッグが増加し、日本のそれと大きく乖離していることを踏まえると、ドラッグロスが拡大している可能性もあります。
そこで、本研究では、米国で承認されたオーファンドラッグの開発状況を分析し、希少疾患領域におけるドラッグロスの傾向及び関連因子、並びにR&Dモデルを検討し、日本におけるシームレスな薬剤開発に寄与する要因を同定することを目的としました。
研究の成果
本研究では、2005年1月から2021年12月までに米国で承認されたオーファンドラッグ(新有効成分含有医薬品)を対象にしました。薬剤/開発状況等に関する情報は、米国食品医薬品局(FDA)、PMDA/MHLW及び欧州医薬品庁(EMA)の公開情報及びClarivate CortellisTMから収集しました。解析データは2022年8月31日時点としました。
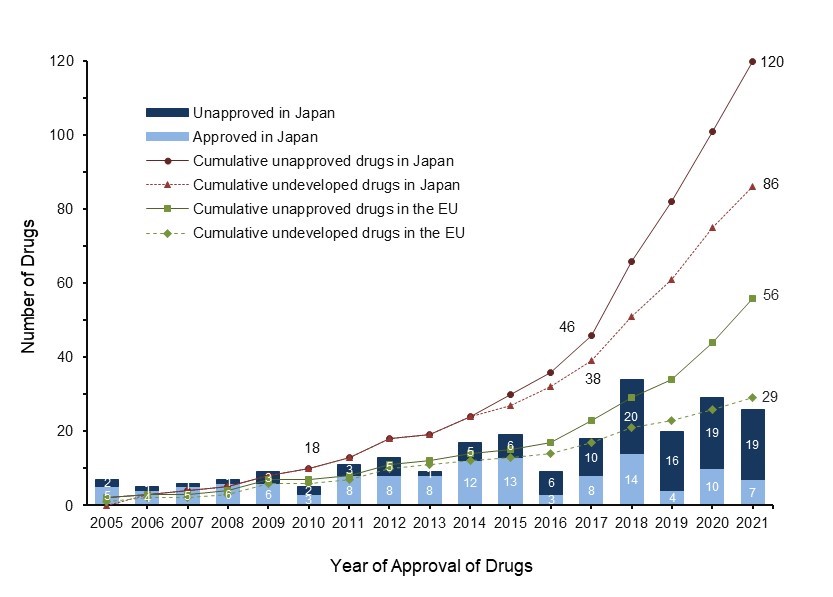
米国では2021年までに249のオーファンドラッグが承認され、その数は2018年から大きく増加しています。それに伴い国内未承認及び未開発の薬剤が急増し、その数は120品目(49%)及び86品目(35%)に達しています(図1)。これは、オーファンドラッグ指定制度が遅れて導入された欧州と比較しても顕著であり、更なるドラッグロスの拡大が予想されます。
米国では2021年までに249のオーファンドラッグが承認され、その数は2018年から大きく増加しています。それに伴い国内未承認及び未開発の薬剤が急増し、その数は120品目(49%)及び86品目(35%)に達しています(図1)。これは、オーファンドラッグ指定制度が遅れて導入された欧州と比較しても顕著であり、更なるドラッグロスの拡大が予想されます。
国内未承認薬と既承認薬の特徴を比較検討したところ、いずれの薬剤もほとんどが海外の企業又はアカデミアから創出されていました(228品目、93%)。既承認薬は主に外資系製薬企業、未承認薬は主に外資系スタートアップで創製され、米国での開発は、既承認薬は日本に事業拠点を持つ外資系の大規模製薬企業、未承認薬は日本に事業拠点を持たない外資系のスタートアップや中小製薬企業を中心に行われていました。また、既承認薬は米国でブレークスルーセラピー*2や迅速承認の指定を受けている、またパートナーシップを通じて開発されるケースがより多くみられました。日本における市場性[ピーク時売上予測(中央値)]は2,210万ドルでした。
多変量ロジスティック回帰分析から、日本での承認とオリジネーターの国籍(外国籍)、米国での医薬品市販承認取得者(MAH)の組織タイプ(スタートアップ)及び米国での承認時期との間に負の関連が認められました。また、薬剤クラス(抗癌剤)及びパートナーシップとの間には正の関連が認められました。
多変量ロジスティック回帰分析から、日本での承認とオリジネーターの国籍(外国籍)、米国での医薬品市販承認取得者(MAH)の組織タイプ(スタートアップ)及び米国での承認時期との間に負の関連が認められました。また、薬剤クラス(抗癌剤)及びパートナーシップとの間には正の関連が認められました。
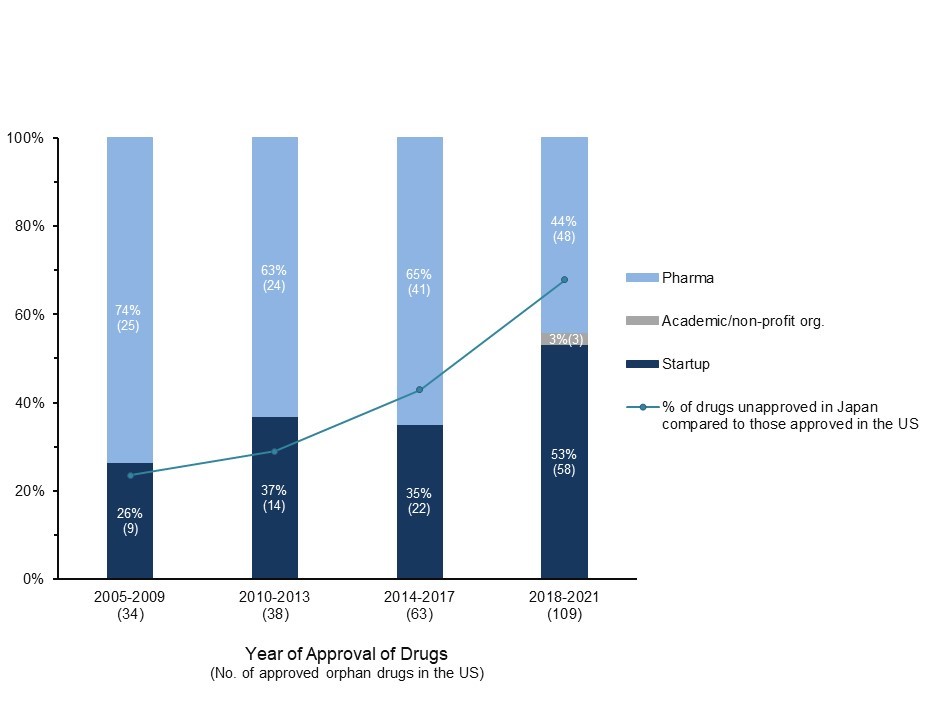
近年、米国では薬剤承認におけるメガファーマのシェアが低下し、創薬エコシステムの成熟、技術プラットフォームや外部開発委託サービスの進歩等を背景に中小企業における研究開発が加速しています。米国におけるオーファンドラッグのMAHの動向を分析したところ、主に欧米を拠点とするスタートアップの割合が年々増加し、2021年までに過半数を占めました。それに伴い、国内未承認薬の割合が増加しており、希少疾患領域におけるR&Dの主体の遷移がドラッグロス拡大に関連していました。
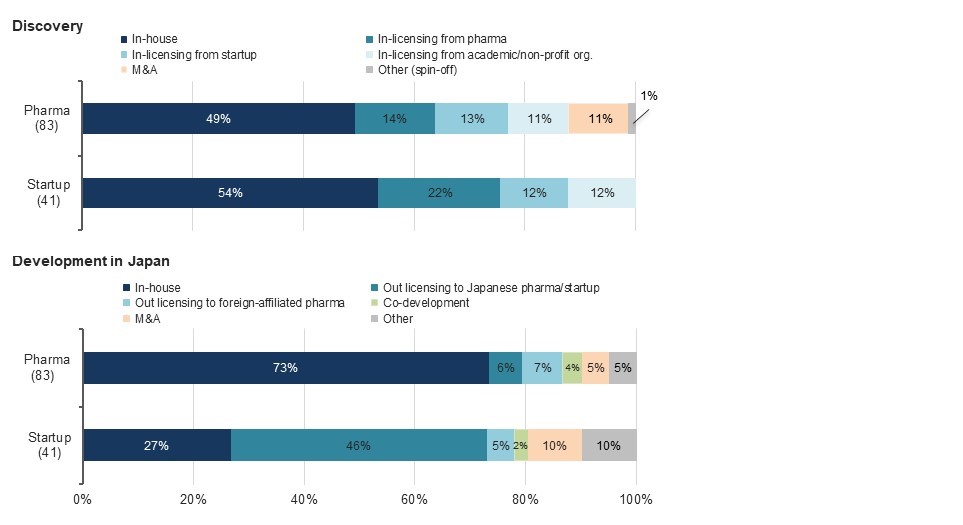
最適なR&D戦略は組織や企業ごとに様々です。米国のMAHであるスタートアップと製薬企業におけるR&Dモデルを比較したところ(図3)、スタートアップは自社創薬(54%)とインライセンス*3(46%)を組み合せてパイプラインを獲得し、主に米国での開発を先行して進めていました。日本への拡大は自社で行うケースは少なく(27%)、米国での承認/申請後又は後期開発段階になって日本企業(46%)や日本に事業基盤を有する外資系製薬企業(5%)へライセンス供与していました。この国内開発開始の遅延は、希少疾患治療薬のドラッグラグの大きな要因となっている可能性があります。また、ライセンス戦略の成功には、薬剤の革新性、対象疾患、ライセンサーの取引能力及びライフサイクルマネジメントによる潜在的な市場拡大の可能性が関連していました。日本における市場性は、一般に薬剤のインライセンス評価時の重要な要素ですが、既承認薬のピーク時売上高予測(中央値)は1,650万ドルであり、閾値は低いと考えられました。
一方、製薬企業は自社創薬(49%)、スタートアップ及びアカデミアからのインライセンス(38%)及び合併買収(M&A:11%)を通じてパイプラインを獲得し、開発は主に自社で米国、日本の順に進めていました(73%)。一部(13%)は日本企業又は日本で高いプレゼンスを持つ外資系製薬企業へアウトライセンス*4していました。これは多くの場合、日本でのビジネスの弱みを補い、又は弱みのある領域を排除し特定の疾患領域に注力することで製品価値の最大化を目指す戦略的提携の一部でした。
これらの結果は、希少疾患領域での創薬における外部イノベーションの重要性を示すとともに、製薬企業とスタートアップでは日本における開発/ビジネス戦略に明確な差異が存在することを示しています。この背景には欧米のスタートアップにとって日本は、薬価制度改革等により相対的に低下する市場性、複雑な薬事規制や治験環境、高い開発コスト、またスタートアップの財政的制約等から必ずしも優先度の高い市場となっていないことがあると考えられました。実際、米国のオーファンドラッグMAHであるスタートアップの95%が欧米を拠点とし、日本に事業基盤を有しているのは34%に過ぎませんでした。
一方、製薬企業は自社創薬(49%)、スタートアップ及びアカデミアからのインライセンス(38%)及び合併買収(M&A:11%)を通じてパイプラインを獲得し、開発は主に自社で米国、日本の順に進めていました(73%)。一部(13%)は日本企業又は日本で高いプレゼンスを持つ外資系製薬企業へアウトライセンス*4していました。これは多くの場合、日本でのビジネスの弱みを補い、又は弱みのある領域を排除し特定の疾患領域に注力することで製品価値の最大化を目指す戦略的提携の一部でした。
これらの結果は、希少疾患領域での創薬における外部イノベーションの重要性を示すとともに、製薬企業とスタートアップでは日本における開発/ビジネス戦略に明確な差異が存在することを示しています。この背景には欧米のスタートアップにとって日本は、薬価制度改革等により相対的に低下する市場性、複雑な薬事規制や治験環境、高い開発コスト、またスタートアップの財政的制約等から必ずしも優先度の高い市場となっていないことがあると考えられました。実際、米国のオーファンドラッグMAHであるスタートアップの95%が欧米を拠点とし、日本に事業基盤を有しているのは34%に過ぎませんでした。
以上から、希少疾患治療薬のドラッグロスは急速に拡大し、その主因は米国において希少疾患領域のR&Dの主体がスタートアップへ遷移したこと、それに伴うR&D戦略の変化にあることが示されました。また、ドラッグロス是正のためには日本企業の欧米のスタートアップとの早期からのパートナーシップ、国内エコシステムの構築を通じた創薬力の強化及び薬事規制の抜本的改革が重要であることが示唆されました。
研究の意義と今後の展開や社会的意義など
高いアンメットニーズにも関わらず、希少疾患治療薬のドラッグロスは拡大しています。本論文ではドラッグロスに関わる要因、希少疾患に対する主要なR&D/ビジネスモデルについて背景を含め網羅的に分析し、エビデンスに基づき対処すべき複数の課題を提起しています。ドラッグロスについては、現在、厚生労働省が主催する「創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会」でその対策が活発に議論されています。本研究結果はドラッグロス解消に向けた一助となることが期待されます。
用語解説
※1 スタートアップ:イノベーションを起こし、社会に新たな価値をもたらすことを目的にビジネスモデルを開発し、短期間で成長している企業・起業家。本研究では1990年代以降の医薬品産業におけるスタートアップの急成長を踏まえ、1990年以降に設立された企業と定義。
※2 ブレークスルーセラピー指定制度:重篤又は生命が脅かされる疾患を対象に、革新的な治療薬の開発・審査の促進を目的にしたFDAの制度。
※3 インライセンス:他社が持つ特許権やノウハウ等に対し、対価を支払って自社に導入すること。
※4 アウトライセンス:自社で取得した特許権やノウハウ等を他社に売却又は使用を許諾すること。
※2 ブレークスルーセラピー指定制度:重篤又は生命が脅かされる疾患を対象に、革新的な治療薬の開発・審査の促進を目的にしたFDAの制度。
※3 インライセンス:他社が持つ特許権やノウハウ等に対し、対価を支払って自社に導入すること。
※4 アウトライセンス:自社で取得した特許権やノウハウ等を他社に売却又は使用を許諾すること。
論文タイトル
Increasing orphan drug loss in Japan: Trends and R&D strategy for rare diseases
著者
塩谷和昭1* 林永周2 仙石慎太郎3 児玉耕太4
所属
1 名古屋市立大学 芸術工学研究科
2 立命館大学 経営学部
3 東京工業大学 環境・社会理工学院
4 名古屋市立大学 データサイエンス学部
所属
1 名古屋市立大学 芸術工学研究科
2 立命館大学 経営学部
3 東京工業大学 環境・社会理工学院
4 名古屋市立大学 データサイエンス学部
掲載学術誌
学術誌名 Drug Discovery Today
DOI番号:https://doi.org/10.1016/j.drudis.2023.103755
DOI番号:https://doi.org/10.1016/j.drudis.2023.103755