TRPV4イオンチャネル阻害の構造基盤を解明~鎮痛剤や遺伝性疾患の治療薬開発に新たな知見~
温度感受性TRPV4チャネルは皮膚表皮細胞や神経細胞、筋肉細胞、骨軟骨細胞等に発現しており、温かい温度や機械刺激、細胞膜由来の脂質等で活性化し、さまざまな細胞機能に関わります。そしてTRPV4の遺伝子変異は、シャルコー・マリー・トゥース病(指定難病10)等のさまざまな遺伝性の骨・筋肉・神経疾患を引き起こすことが知られています。しかし、治療薬としてのTRPV4に作用する薬剤は未だ開発されていません。今回、自然科学研究機構 生理学研究所/生命創成探究センターの富永真琴前教授(現:名古屋市立大学 なごや先端研究開発センター特任教授)と生理学研究所のJing Lei前博士研究員は、中国 北京大学 化学与分子工程学院のXiaoguang Lei教授との共同研究で、低温電子顕微鏡を用いて2つのTRPV4阻害剤がヒトTRPV4を阻害する構造基盤を明らかにしました。TRPV4チャネルを標的とした薬剤開発に貢献できると推定されます。本研究結果は、Advanced Scienceに掲載(2024年4月24日公開)されました。
2021年にはイオンチャネルの一つであるTPRチャネルの研究にノーベル生理学医学賞が授与されました。温度感受性TRPチャネルは、冷たい温度から熱い温度まで様々な温度等を感知するタイプがあり、現在11種知られています。中でもTRPV4チャネルは皮膚表皮細胞や骨・筋肉・神経の細胞に発現し、体温近くの温かい温度刺激や機械刺激、細胞膜由来の脂質等で活性化されます。また、TRPV4遺伝子変異によるTRPV4イオンチャネル機能異常が、シャルコー・マリー・トゥース病(我が国の指定難病10番)等のさまざまな遺伝性の骨・筋肉・神経疾患を引き起こすことが知られています。TRPV4の構造は2017年にノーベル化学賞が授与された「低温電子顕微鏡を用いた単粒子解析法」を用いて既に原子レベルで明らかにされていますが、TRPV4を標的とした薬剤は最終的には我々の手に届くに至っていません。いくつかの化合物で臨床治験が行われており、イギリスの製薬大手GSK(グラクソ・スミスクライン)が開発したGSK2798745は先天性心疾患による肺水腫の治療薬として治験ステージIの状態です。一方、日本の塩野義製薬は2',4'-dimethyl-[4,5'-bithiazol]-2-yl amino derivativesのTRPV4阻害による鎮痛を目指して開発を進めています。これらの化合物がTPRV4を阻害する際のメカニズムを知ることは、今後の薬剤開発にも非常に重要です。
そこで研究グループはGSK2798745によく似た低分子化合物であるGSK3527497(化合物1)と2',4'-dimethyl-[4,5'-bithiazol]-2-yl amino derivatives(化合物2)のTRPV4阻害効果と、そのメカニズムを調べるため、実験を行いました。
先ず、ヒトTRPV4を発現させたハムスター卵巣由来の細胞(CHO細胞)を用いて2つの薬剤の阻害濃度を検討し、化合物1と化合物2はいずれも強い阻害剤であることを確認しました。
そこで、これらの阻害剤がTRPV4にどのように作用しているのかを構造的に調べるために、低温電子顕微鏡法を用いて、2つのTRPV4阻害剤(化合物1と化合物2)が結合したヒトTRPV4の構造を原子レベル(4Å※1以下)の解像度で解析しました。その結果、化合物1と化合物2は、TRPV4チャネルの第4膜貫通ドメイン(図1)のvoltage sensing-like domains (VSLDs) ※2のポケットに結合することが分かりました(図2、3)。それぞれの化合物の結合部位は異なっているものの、非常に近く、一部重なっていました。そして、いずれの化合物が結合している場合も、ヒトTRPV4は閉状態を示しており、イオンを通さない状態であることも分かりました。
さらに、それぞれの化合物の結合に重要なアミノ酸を同定するため、いくつかのアミノ酸を人為的に他のアミノ酸に変更する解析を行いました。その結果TRPヘリックス※3のアミノ酸など(図2、3)を変異させたときに、阻害効果が減弱することが明らかになりました。これらの結果より、今回同定したアミノ酸が、TRPV4チャネルの開閉に重要であることが分かります。いずれの化合物も、VSLDポケットに結合することによって、TRPヘリックスとVSLDの連関を安定化させてイオンチャネルを閉状態にするものと推定されます。
このように、2つの強力な低分子ヒトTRPV4阻害剤の阻害構造基盤が明らかになったことによって、ヒトTRPV4を標的とした薬剤開発がさらに進展することが期待されます。
本研究は文部科学省科学研究費補助金の補助を受けて行われました。
そこで研究グループはGSK2798745によく似た低分子化合物であるGSK3527497(化合物1)と2',4'-dimethyl-[4,5'-bithiazol]-2-yl amino derivatives(化合物2)のTRPV4阻害効果と、そのメカニズムを調べるため、実験を行いました。
先ず、ヒトTRPV4を発現させたハムスター卵巣由来の細胞(CHO細胞)を用いて2つの薬剤の阻害濃度を検討し、化合物1と化合物2はいずれも強い阻害剤であることを確認しました。
そこで、これらの阻害剤がTRPV4にどのように作用しているのかを構造的に調べるために、低温電子顕微鏡法を用いて、2つのTRPV4阻害剤(化合物1と化合物2)が結合したヒトTRPV4の構造を原子レベル(4Å※1以下)の解像度で解析しました。その結果、化合物1と化合物2は、TRPV4チャネルの第4膜貫通ドメイン(図1)のvoltage sensing-like domains (VSLDs) ※2のポケットに結合することが分かりました(図2、3)。それぞれの化合物の結合部位は異なっているものの、非常に近く、一部重なっていました。そして、いずれの化合物が結合している場合も、ヒトTRPV4は閉状態を示しており、イオンを通さない状態であることも分かりました。
さらに、それぞれの化合物の結合に重要なアミノ酸を同定するため、いくつかのアミノ酸を人為的に他のアミノ酸に変更する解析を行いました。その結果TRPヘリックス※3のアミノ酸など(図2、3)を変異させたときに、阻害効果が減弱することが明らかになりました。これらの結果より、今回同定したアミノ酸が、TRPV4チャネルの開閉に重要であることが分かります。いずれの化合物も、VSLDポケットに結合することによって、TRPヘリックスとVSLDの連関を安定化させてイオンチャネルを閉状態にするものと推定されます。
このように、2つの強力な低分子ヒトTRPV4阻害剤の阻害構造基盤が明らかになったことによって、ヒトTRPV4を標的とした薬剤開発がさらに進展することが期待されます。
本研究は文部科学省科学研究費補助金の補助を受けて行われました。
今回の発見
- 2つのヒトTRPV4の低分子阻害剤が結合した状態での原子レベルの構造が4Å以下の高い解像度で明らかになりました。
- その2つのヒトTRPV4の低分子阻害剤は、Voltage Sensing-Like Domains (VSLDs)の異なるポケットに結合することが分かりました。
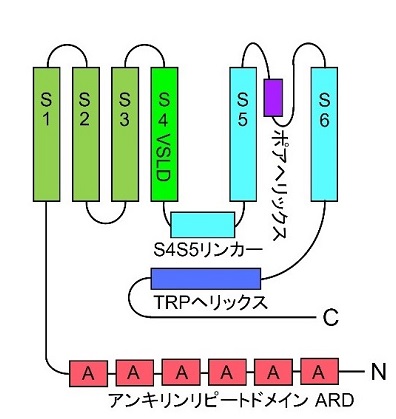
図1 TRPV4の一つサブユニットの構造モデル
6回の膜貫通ドメイン(S1 - S6)をもち、カルボキシル末端(C)のTRPヘリックスはS4S5リンカーに近く、イオンチャネル機能の制御に関わっています。第4膜貫通ドメイン(S4)にVoltage Sensing-Like Domains (VSLD)があります。アミノ末端(N)のアンキリンリピートドメインにはさまざまな蛋白質が結合してイオンチャネル機能を制御します。
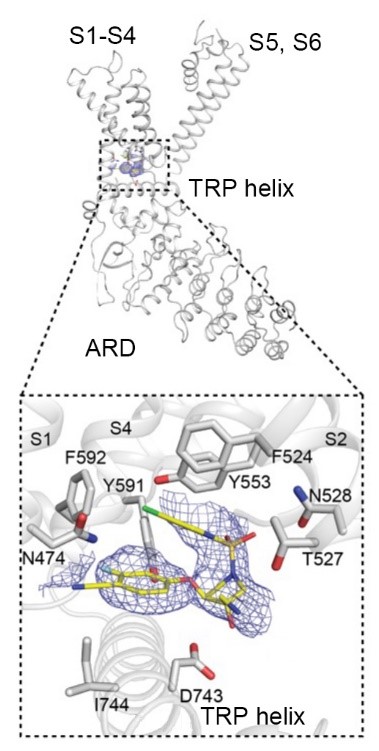
図2 ヒトTRPV4へのGSK3527497の結合
低温電子顕微鏡法によるヒトTRPV4の一部とGSK3527497(化合物1)の構造。
化合物1はヒトTRPV4のVoltage Sensing-Like Domains (VSLD)に結合することが分かりました。青い網のように見えるのがGSK3527497。
化合物1の結合には、膜貫通 ヘリックスS2のF(フェニルアラニン)524とT(スレオニン)527、S4の Y(チロシン)591とF592、S3のY553、S1のN(アスパラギン)474、TRP ヘリックスの D(アスパラギン酸)743が関わっていることが明らかになりました。
化合物1はヒトTRPV4のVoltage Sensing-Like Domains (VSLD)に結合することが分かりました。青い網のように見えるのがGSK3527497。
化合物1の結合には、膜貫通 ヘリックスS2のF(フェニルアラニン)524とT(スレオニン)527、S4の Y(チロシン)591とF592、S3のY553、S1のN(アスパラギン)474、TRP ヘリックスの D(アスパラギン酸)743が関わっていることが明らかになりました。
![図3 ヒトTRPV4への2',4'-dimethyl-[4,5'-bithiazol]-2-yl amino derivativesの結合](https://www.nagoya-cu.ac.jp/media/20240430-3.jpg)
図3 ヒトTRPV4への2',4'-dimethyl-[4,5'-bithiazol]-2-yl amino derivativesの結合
低温電子顕微鏡法によるヒトTRPV4の一部と2',4'-dimethyl-[4,5'-bithiazol]-2-yl amino derivatives(化合物2)の構造。
化合物2もヒトTRPV4のVoltage Sensing-Like Domains (VSLD)に結合することが分かりました。青い網のように見えるのが化合物2。化合物2の結合には、S1のV(バリン)469, S(セリン)470, I(イソロイシン)473、S4の N474とY591、TRP ヘリックスのI744 とF748が関わっていることが明らかになりました。
化合物2もヒトTRPV4のVoltage Sensing-Like Domains (VSLD)に結合することが分かりました。青い網のように見えるのが化合物2。化合物2の結合には、S1のV(バリン)469, S(セリン)470, I(イソロイシン)473、S4の N474とY591、TRP ヘリックスのI744 とF748が関わっていることが明らかになりました。
この研究の社会的意義
今回の研究から、TRPV4チャネルの低分子阻害剤開発が進み、薬剤が患者さんに届くようになるものと期待されます。
<用語解説>
注1.Å(オングストローム):1Å=10−10m を示す長さの単位。
注2.voltage sensing-like domains (VSLDs):電位作動性(電位の変化を感知して開口する)チャネルや電位依存性酵素は第4膜貫通ドメインに電位を感知する特徴的なアミノ酸がある。電位作動性チャネルでないイオンチャネルでも同様のアミノ酸の集まりがあり、voltage sensing-like domains (VSLDs)と呼ばれる。
注3.TRP ヘリックス:複数のTRPチャネルに共通するヘリックス構造で、膜貫通ドメインとカルボキシ末端の間に位置し、第1−4膜貫通ドメインに近く、いくつかの重要なTRPチャネルの機能に関わる。
<用語解説>
注1.Å(オングストローム):1Å=10−10m を示す長さの単位。
注2.voltage sensing-like domains (VSLDs):電位作動性(電位の変化を感知して開口する)チャネルや電位依存性酵素は第4膜貫通ドメインに電位を感知する特徴的なアミノ酸がある。電位作動性チャネルでないイオンチャネルでも同様のアミノ酸の集まりがあり、voltage sensing-like domains (VSLDs)と呼ばれる。
注3.TRP ヘリックス:複数のTRPチャネルに共通するヘリックス構造で、膜貫通ドメインとカルボキシ末端の間に位置し、第1−4膜貫通ドメインに近く、いくつかの重要なTRPチャネルの機能に関わる。
論文情報
Structural pharmacological inhibition of TRPV4 antagonists
Junping Fan, Chang Guo, Daohong Liao, Han Ke, Jing Lei, Wenjun Xie, Yuliang Tang, Makoto Tominaga, Zhuo Huang, and Xiaoguang Lei C.
Advanced Science
(2024年4月24日公開)
DOI: http://doi.org/10.1002/advs.202401583
Junping Fan, Chang Guo, Daohong Liao, Han Ke, Jing Lei, Wenjun Xie, Yuliang Tang, Makoto Tominaga, Zhuo Huang, and Xiaoguang Lei C.
Advanced Science
(2024年4月24日公開)
DOI: http://doi.org/10.1002/advs.202401583

