骨格筋の抗酸化物質の産生を制御する新たなメカニズムを解明〜「悪者」と思われがちな炎症性サイトカインの意外な一面を発見〜
研究成果の概要
名古屋市立大学大学院理学研究科の山田麻未研究員と奥津光晴教授らの研究グループは、骨格筋の抗酸化物質の発現を調節する新たな分子機構を解明しました。
加齢や慢性疾患(がん、糖尿病、心不全や腎不全など)は酸化ストレス※1を増大し骨格筋量の減少(筋萎縮)を誘導します。筋萎縮は、身体活動の低下による廃用性症候群の発症や活動範囲の低下による生活の質(QOL)の悪化などに関与することから、筋萎縮を発症する分子機構の解明と効果的な予防方法の確立は重要な課題です。これまで奥津教授らは、炎症性サイトカイン※2であるインターロイキン1β(Interleukin-1β: IL-1β)※3の一過性の刺激は骨格筋の抗酸化物質※4の発現と分泌を促進し、酸化ストレスを軽減することで筋萎縮を抑制することを報告しています(Yamada M, et al. J Physiol 2023)。しかしながら、その分子機構は明らかではありませんでした。本研究では、IL-1βが抗酸化物質の産生を制御する分子機構を初めて解明しました。
これらの結果は、筋量を維持する新たな分子メカニズムの理解と予防医学や健康科学の分野への貢献が期待できます。この論文は、山田研究員を筆頭著者、奥津光晴教授を責任著者として生理学の国際雑誌『The Journal of Physiology』のwebサイトに2024年8月21日に掲載されました。
加齢や慢性疾患(がん、糖尿病、心不全や腎不全など)は酸化ストレス※1を増大し骨格筋量の減少(筋萎縮)を誘導します。筋萎縮は、身体活動の低下による廃用性症候群の発症や活動範囲の低下による生活の質(QOL)の悪化などに関与することから、筋萎縮を発症する分子機構の解明と効果的な予防方法の確立は重要な課題です。これまで奥津教授らは、炎症性サイトカイン※2であるインターロイキン1β(Interleukin-1β: IL-1β)※3の一過性の刺激は骨格筋の抗酸化物質※4の発現と分泌を促進し、酸化ストレスを軽減することで筋萎縮を抑制することを報告しています(Yamada M, et al. J Physiol 2023)。しかしながら、その分子機構は明らかではありませんでした。本研究では、IL-1βが抗酸化物質の産生を制御する分子機構を初めて解明しました。
これらの結果は、筋量を維持する新たな分子メカニズムの理解と予防医学や健康科学の分野への貢献が期待できます。この論文は、山田研究員を筆頭著者、奥津光晴教授を責任著者として生理学の国際雑誌『The Journal of Physiology』のwebサイトに2024年8月21日に掲載されました。
背景
がん、糖尿病、心不全や腎不全などの慢性疾患や加齢は骨格筋の恒常性を破綻し筋萎縮を誘導します。加齢による筋萎縮は廃用性症候群による寝たきりの要因であること、また、慢性疾患による筋萎縮は体力の低下を引き起こし治療の妨げになることが報告されています。したがって、筋萎縮を発症する分子機構の解明と効果的な予防方法の確立は、健康寿命の延伸やQOLの維持および向上の観点から重要な課題です。加齢や慢性疾患による筋萎縮は、酸化ストレスの増大による筋タンパクの分解の促進と合成の抑制が原因であることが報告されています。代表的な酸化ストレス因子である活性酸素種は、スーパーオキサイドディスミュターゼ(Superoxide Dismutase:SOD)やカタラーゼ(catalase)などの抗酸化物質により分解されます。したがって、骨格筋におけるこれらの抗酸化物質の増加は、筋萎縮の抑制に貢献する可能性が期待できます。これまで奥津教授らの研究グループは、炎症性サイトカインであるIL-1βの一過性の刺激は、骨格筋の抗酸化物質の発現と分泌を促進することで酸化ストレスを軽減し、筋萎縮を抑制することを報告しています(Yamada M, et al. J Physiol 2023)。しかしながら、その分子機構は十分には明らかにされていませんでした。
研究の成果
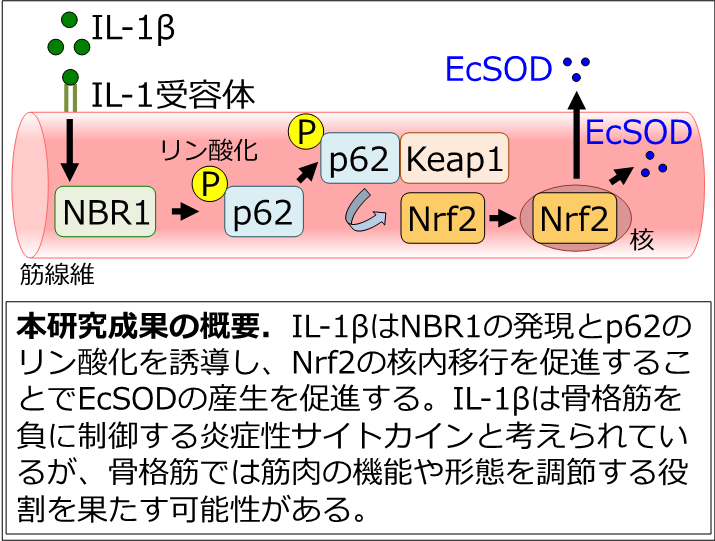
この度、名古屋市立大学大学院理学研究科の山田麻未研究員と奥津光晴教授は、抗酸化物質を産生する新たな分子機構を解明しました。
がん悪液質は筋萎縮を誘導します。がん悪液質による筋萎縮は酸化ストレスの増大が要因であることから、抗酸化機能の向上はがん悪液質による筋萎縮の抑制が期待できます。また酸化ストレスの増大による筋萎縮は、加齢や慢性疾患で見られる筋萎縮の要因であることから、本研究は、特定の疾患による筋萎縮の抑制方法の確立にとどまらず、ヒトで見られる筋萎縮の予防や軽減に広く応用できる可能性が期待できます。本研究では、がん悪液質は酸化ストレスを増大するが、骨格筋は分泌型の抗酸化酵素であるExtracellular Superoxide Dismutase (EcSOD)※5の発現と分泌を増加し、骨格筋の量や機能を維持することを発見しました。EcSODの発現を制御する分子機構を解明するため、がん悪液質を誘導したマウス骨格筋を詳細に解析した結果、EcSODが増加する分子機構としてSQSTM1/p62(p62)※6のリン酸化によるNrf2※7の核内移行が関与することを立証しました。このp62のリン酸化を誘導する因子を探索するため、骨格筋の炎症性サイトカインに着目し網羅的に解析しました。その結果、がん悪液質により増加するIL-1βはp62のリン酸化、Nrf2の活性化とEcSODの増加を誘導しました。さらに、IL-1βによるEcSODの増加に対するp62のリン酸化とNrf2の活性化の重要性を立証するため、筋特異的にp62あるいはNrf2の発現を欠損したマウスの骨格筋にIL-1βを投与しEcSODの変動を評価しました。その結果、野生型マウスで見られるEcSODの増加は、骨格筋のp62やNrf2を欠損したマウスでは観察されませんでした。先行研究では、IL-1βに代表される炎症性サイトカインは筋萎縮を誘導する「悪い因子」として報告されています。本研究では、適度なIL-1βの刺激はp62のリン酸化とNrf2の活性化を誘導することでEcSODを増加し、筋萎縮の抑制に貢献する可能性を初めて立証しました。本研究成果は、IL-1βの調節が加齢や慢性疾患などの酸化ストレスの増大による筋萎縮の抑制に対する潜在的な治療や予防のアプローチである可能性を示しています。
がん悪液質は筋萎縮を誘導します。がん悪液質による筋萎縮は酸化ストレスの増大が要因であることから、抗酸化機能の向上はがん悪液質による筋萎縮の抑制が期待できます。また酸化ストレスの増大による筋萎縮は、加齢や慢性疾患で見られる筋萎縮の要因であることから、本研究は、特定の疾患による筋萎縮の抑制方法の確立にとどまらず、ヒトで見られる筋萎縮の予防や軽減に広く応用できる可能性が期待できます。本研究では、がん悪液質は酸化ストレスを増大するが、骨格筋は分泌型の抗酸化酵素であるExtracellular Superoxide Dismutase (EcSOD)※5の発現と分泌を増加し、骨格筋の量や機能を維持することを発見しました。EcSODの発現を制御する分子機構を解明するため、がん悪液質を誘導したマウス骨格筋を詳細に解析した結果、EcSODが増加する分子機構としてSQSTM1/p62(p62)※6のリン酸化によるNrf2※7の核内移行が関与することを立証しました。このp62のリン酸化を誘導する因子を探索するため、骨格筋の炎症性サイトカインに着目し網羅的に解析しました。その結果、がん悪液質により増加するIL-1βはp62のリン酸化、Nrf2の活性化とEcSODの増加を誘導しました。さらに、IL-1βによるEcSODの増加に対するp62のリン酸化とNrf2の活性化の重要性を立証するため、筋特異的にp62あるいはNrf2の発現を欠損したマウスの骨格筋にIL-1βを投与しEcSODの変動を評価しました。その結果、野生型マウスで見られるEcSODの増加は、骨格筋のp62やNrf2を欠損したマウスでは観察されませんでした。先行研究では、IL-1βに代表される炎症性サイトカインは筋萎縮を誘導する「悪い因子」として報告されています。本研究では、適度なIL-1βの刺激はp62のリン酸化とNrf2の活性化を誘導することでEcSODを増加し、筋萎縮の抑制に貢献する可能性を初めて立証しました。本研究成果は、IL-1βの調節が加齢や慢性疾患などの酸化ストレスの増大による筋萎縮の抑制に対する潜在的な治療や予防のアプローチである可能性を示しています。
研究のポイント
- 加齢や慢性疾患は酸化ストレスを増大し筋萎縮を誘導するが、これを軽減する効果的な方法の確立は未だ十分ではない。
- 本研究では、がん悪液質を誘導したマウスを用い骨格筋の抗酸化物質の産生を調節する分子機構の解明を目的とした。
- がん悪液質は骨格筋のEcSODの発現を増加したが、その増加にはIL-1βが関与した。
- IL-1βは、p62のリン酸化とNrf2の活性化を誘導しEcSODの発現と分泌を促進した。
- これらの成果は、IL-1βを標的とした治療薬の開発、栄養素の探索や運動プログラムの確立に応用することにより医学や健康科学の分野への貢献が期待できる。
研究の意義と今後の展開や社会的意義など
IL-1βなどの炎症性サイトカインは骨格筋の萎縮を促進する「悪い因子」と一般的に考えられています。本研究では、IL-1βは、NBR1-p62-Nrf2の経路を介して筋萎縮を抑制するEcSODの発現を増加することを立証しました。筋量維持に対するIL-1β、NBR1、p62とNrf2の生理学的役割を立証した本研究成果は、骨格筋生物学におけるこれまでの常識を覆す新しい概念です。また、本研究成果は予防医学や健康科学への応用が期待できることから社会的意義も大きいと考えられます。
【用語解説】
※1酸化ストレス
活性酸素種が過剰に産生された細胞、臓器や生体の状態。
※2 炎症性サイトカイン
炎症により誘導される生理活性物質(サイトカイン)の総称。インターロイキン1の他、インターロイキン6、インターフェロンγや腫瘍壊死因子α(Tumor Necrosis Factor-α)などがある。
※3 インターロイキン1β(Interuleukin-1β: IL-1β)
代表的な炎症性サイトカイン。マクロファージや単球などの免疫細胞の他、筋細胞も産生する。
※4 抗酸化物質
活性酸素種を分解する働きを持つ生体内で合成される物質。
※5 Extracellular Superoxide Dismutase (EcSOD)
分泌型の抗酸化酵素。活性酸素種を過酸化水素に分解する働きがある。
※6 SQSTM1/p62 (p62)
細胞内に発現するタンパク。リン酸化すると細胞内に発現するKeap1に選択的に結合し、Keap1とNrf2の結合を阻害することでNrf2の核内移行を促進する。オートファジーやユビキチン-プロテアソーム系の活性を調節する働きもある。
※7 Nrf2(Nuclear factor erythroid 2-related factor 2)
細胞内に発現するタンパク。正常な状態はKeap1と結合するが、ストレス状態では活性化され核内に移行し、抗酸化剤応答配列(ARE:antioxidant response element)に結合して抗酸化物質の産生を促進する。
【研究助成】
本研究は、科学研究費補助金 基盤B(15H03080, 18H03153, 21H03326, 24H02817)、挑戦的萌芽(20K21766)、若手研究(22K17733, 24K20566)、日本学術振興会特別研究員(20J15551)、鈴木謙三記念医科学応用研究財団、豊秋奨学会、中富健康科学振興財団、上原記念生命科学財団、名古屋市立大学特別研究奨励費(2321103)の助成により遂行されました。
【論文タイトル】
Muscle-derived IL-1β regulates EcSOD expression via the NBR1-p62-Nrf2 pathway in muscle during cancer cachexia.
【著者】
山田 麻未1、蕨 栄治2、大石 久史3、Vitor Agnew Lira4、奥津 光晴1*
所属
1 名古屋市立大学大学院理学研究科(*:Corresponding Author)
2 筑波大学医学医療系
3 名古屋市立大学大学院医学研究科
4 アイオワ大学
【掲載学術誌】
学術誌名 The Journal of Physiology
DOI番号:https://doi.org/10.1113/JP286460

