停止状態を狙え!アミロイドβ線維の成長メカニズムを解明し、アルツハイマー病の進行を阻止する新たな手がかり
発表のポイント
•アルツハイマー病の原因物質であるアミロイドβ(Aβ)の線維が、どのように成長するのかを分子レベルで明らかにしました。
•Aβ線維の成長は、2本のプロトフィラメント(細い線維)が交互に伸びるパターンで進行し、先端が揃った時に成長が一時的に停止することを発見しました。
•4396C抗体が線維成長の「停止状態」に選択的に結合し、Aβ線維のさらなる成長を効果的に阻止するメカニズムを解明しました。
•この研究成果は、アルツハイマー病の成立並びに進行過程を分子レベルで阻止する新たな予防法・治療法の開発に繋がる可能性があります。
•Aβ線維の成長は、2本のプロトフィラメント(細い線維)が交互に伸びるパターンで進行し、先端が揃った時に成長が一時的に停止することを発見しました。
•4396C抗体が線維成長の「停止状態」に選択的に結合し、Aβ線維のさらなる成長を効果的に阻止するメカニズムを解明しました。
•この研究成果は、アルツハイマー病の成立並びに進行過程を分子レベルで阻止する新たな予防法・治療法の開発に繋がる可能性があります。
研究の背景
アルツハイマー病は、記憶や認知機能の低下を引き起こす深刻な神経変性疾患です。その原因の一つは、脳内で異常に蓄積されるアミロイドβ(Aβ)というタンパク質です。このAβが積み重なって「線維」と呼ばれる塊を形成し、これが神経細胞に悪影響を及ぼします。Aβ線維の成長を阻止することが、アルツハイマー病の治療において重要とされていますが、その成長過程や停止メカニズムはこれまで詳しくわかっていませんでした。
研究の成果
自然科学研究機構生命創成探究センター/分子科学研究所、名古屋市立大学大学院薬学研究科、名古屋大学大学院理学研究科、筑波大学プレシジョン・メディスン開発研究センターの研究チームは、最先端技術である高速原子間力顕微鏡(HS-AFM)を用いて、Aβ線維がどのように成長するのかを分子レベルでリアルタイムに観察しました。その結果、1本のAβ線維が2本のプロトフィラメントから構成され、Aβ分子が交互に結合することで線維が伸びていくことが明らかになりました。
さらに、2本のプロトフィラメントの先端が揃う「整列状態」では、線維の成長が一時的に停止する「停止状態」が頻繁に発生することが確認されました。この停止状態は、Aβ線維の成長過程において自然に生じる重要なステップです。
加えて、4396Cという特異的な抗体が、この停止状態にある線維の先端に選択的に結合し、線維のさらなる伸長を効果的に阻止することがわかりました。これにより、Aβ線維の成長が完全に停止し、進行を抑制するメカニズムが明らかになりました。
さらに、2本のプロトフィラメントの先端が揃う「整列状態」では、線維の成長が一時的に停止する「停止状態」が頻繁に発生することが確認されました。この停止状態は、Aβ線維の成長過程において自然に生じる重要なステップです。
加えて、4396Cという特異的な抗体が、この停止状態にある線維の先端に選択的に結合し、線維のさらなる伸長を効果的に阻止することがわかりました。これにより、Aβ線維の成長が完全に停止し、進行を抑制するメカニズムが明らかになりました。
成果の意義および今後の展開
この研究により、Aβ線維の成長が「交互伸長と停止」を繰り返す独自のメカニズムが明らかになりました。これはアルツハイマー病の進行に関与する新しい要素を解明したものであり、特にAβ線維の「停止状態」に着目した治療法の開発につながる可能性を示しています。
今後の研究では、4396C抗体の作用メカニズムをさらに詳しく解明することで、Aβ線維の成長を抑える新たな治療法の実現が期待されます。また、今回の成果を基に、他のアミロイド性疾患への応用も視野に入れたさらなる研究を進める予定です。
本研究は、2024年10月24日に国際学術誌「Journal of the American Chemical Society」にオンライン公開されます。
今後の研究では、4396C抗体の作用メカニズムをさらに詳しく解明することで、Aβ線維の成長を抑える新たな治療法の実現が期待されます。また、今回の成果を基に、他のアミロイド性疾患への応用も視野に入れたさらなる研究を進める予定です。
本研究は、2024年10月24日に国際学術誌「Journal of the American Chemical Society」にオンライン公開されます。
用語説明
アミロイドβ(Aβ):アミロイドβは、アルツハイマー病に関連するタンパク質で、脳内で異常に蓄積することで神経細胞にダメージを与える。Aβ分子が重合して線維状の構造を形成することが病気の進行に関与している。
プロトフィラメント:アミロイドβ線維を構成する細い原線維のこと。2本のプロトフィラメントが交互に伸長しながらAβ線維を形成する。
高速原子間力顕微鏡(HS-AFM):物質の表面を非常に高い分解能で観察できる最先端の顕微鏡技術。タンパク質の動きや構造をリアルタイムで見ることができる。
プロトフィラメント:アミロイドβ線維を構成する細い原線維のこと。2本のプロトフィラメントが交互に伸長しながらAβ線維を形成する。
高速原子間力顕微鏡(HS-AFM):物質の表面を非常に高い分解能で観察できる最先端の顕微鏡技術。タンパク質の動きや構造をリアルタイムで見ることができる。
参考図
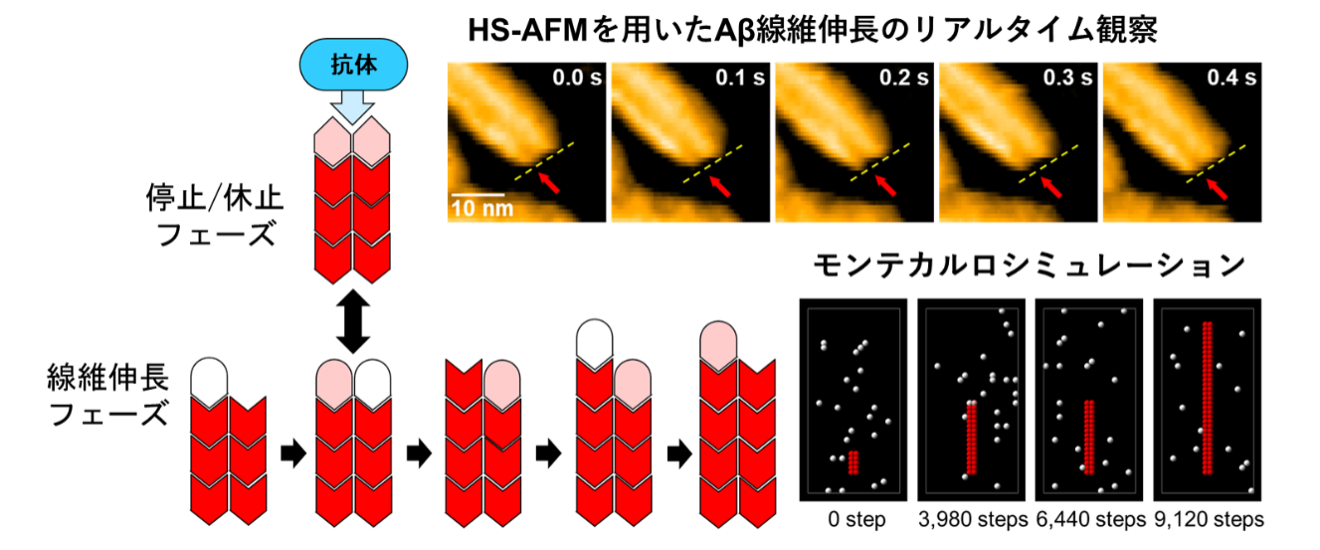
高速原子間力顕微鏡(HS-AFM)とモンテカルロシミュレーションを組み合わせて、アミロイドβ(Aβ)線維が交互に伸長して停止する様子を捉えました。4396C抗体が線維成長の「停止状態」に選択的に結合し、Aβ線維のさらなる成長を効果的に阻止するメカニズムを解明しました
論文情報
タイトル:Single-molecule kinetic observation of antibody interactions with growing amyloid β fibrils
著者:Maho Yagi-Utsumi, Yui Kanaoka, Shogo Miyajima, Satoru G. Itoh, Katsuhiko Yanagisawa, Hisashi Okumura, Takayuki Uchihashi and Koichi Kato
掲載誌:Journal of the American Chemical Society
DOI:https://doi.org/10.1021/jacs.4c08841
論文公開日:2024年10月24日
著者:Maho Yagi-Utsumi, Yui Kanaoka, Shogo Miyajima, Satoru G. Itoh, Katsuhiko Yanagisawa, Hisashi Okumura, Takayuki Uchihashi and Koichi Kato
掲載誌:Journal of the American Chemical Society
DOI:https://doi.org/10.1021/jacs.4c08841
論文公開日:2024年10月24日
著者情報
矢木真穂(生命創成探究センター、名古屋市立大学)、金岡優依(名古屋大学)、宮島将吾(名古屋大学)、伊藤暁(生命創成探究センター、分子科学研究所)、柳澤勝彦(筑波大学、国立長寿医療研究センター)、奥村久士(生命創成探究センター、分子科学研究所)、内橋貴之(生命創成探究センター、名古屋大学)、加藤晃一(生命創成探究センター、分子科学研究所、名古屋市立大学)
研究サポート
本研究は、以下の助成金により部分的に支援されました。
科学研究費補助金(JP19K07041矢木真穂、JP21K06118奥村久士、JP21H00393、JP21H01772内橋貴之)、JST戦略的創造研究推進事業さきがけ(JPMJPR22AC矢木真穂)、文部科学省・学際領域展開ハブ形成プログラム・マルチスケール量子-古典インターフェース研究コンソーシアム(JPMXP1323015482)、AMED創薬等先端技術支援基盤プラットフォーム(JP24ama121005)、名古屋市立大学研究助成金(2212008、2222004、 2412012矢木真穂)、内藤記念財団海外留学助成金、生命創成探究センター共同研究(22EXC338、23EXC305、24EXC329柳澤勝彦、18-101内橋貴之)、生命創成探究センタープロジェクト研究(22EXC601加藤晃一、内橋貴之)
科学研究費補助金(JP19K07041矢木真穂、JP21K06118奥村久士、JP21H00393、JP21H01772内橋貴之)、JST戦略的創造研究推進事業さきがけ(JPMJPR22AC矢木真穂)、文部科学省・学際領域展開ハブ形成プログラム・マルチスケール量子-古典インターフェース研究コンソーシアム(JPMXP1323015482)、AMED創薬等先端技術支援基盤プラットフォーム(JP24ama121005)、名古屋市立大学研究助成金(2212008、2222004、 2412012矢木真穂)、内藤記念財団海外留学助成金、生命創成探究センター共同研究(22EXC338、23EXC305、24EXC329柳澤勝彦、18-101内橋貴之)、生命創成探究センタープロジェクト研究(22EXC601加藤晃一、内橋貴之)

