タンパク質修飾技術で細胞内輸送を制御して糖鎖修飾をコントロール:バイオ医薬品の開発を加速!
名古屋市立大学薬学研究科の矢木宏和准教授(生命創成探究センター客員)と自然科学研究機構 生命創成探究センターの加藤晃一教授(名古屋市立大学/分子科学研究所兼任)らの研究グループは、バイオ医薬品などの製造に用いられる組換え糖タンパク質の糖鎖修飾を促進する画期的な技術を開発しました。この技術は、糖タンパク質に特定のアミノ酸配列(パスポート配列)を付加することで、糖鎖の成熟化を促進し、高品質なバイオ医薬品の生産効率向上に繋がるものです。本研究成果は、日本時間2024年11月22日に、オープンアクセス学術誌「iScience」にpre-proof 版にてWeb 公開されました。
本研究成果のポイント
細胞内での糖鎖修飾をコントロールする「パスポート配列」の働きを明らかにしました。このパスポート配列を組み込むことで、エリスロポエチンなどの糖タンパク質が特定のゴルジ体の領域を通過し、適切な糖鎖修飾を受けやすくなることが判明しました。本研究では、この「パスポート配列」が特定のゴルジ体内環境においてシアル酸やガラクトースを有する糖鎖の形成を促進することを見出しました。本成果は、バイオ医薬品の糖鎖修飾を向上させる新たな戦略として期待されます。
背景
バイオ医薬品[注1]は、がんや自己免疫疾患など様々な疾患の治療に用いられる重要な医薬品です。多くのバイオ医薬品は糖タンパク質であり、その糖鎖構造は薬効、体内動態、免疫原性など、医薬品の品質に大きく影響します。例えば、シアル酸修飾が進めば、バイオ医薬品の血中半減期が伸長することが知られています。そのため、糖鎖修飾の制御はバイオ医薬品の開発において非常に重要です。
私達はこれまでに、血液凝固因子由来の10残基のアミノ酸配列を目的とする糖タンパク質につなげるだけで、その生産量を高められることを示し、本配列を「パスポート配列」として提唱してきました。糖鎖修飾は、分泌経路とくにゴルジ体を通過するときに形作られることが知られていることから、パスポート配列が糖鎖修飾に影響を与えるものとして予想し、本研究を実施しました。特に、パスポート配列とゴルジ体に存在するタンパク質や糖転移酵素との分泌経路中の出会いに着目することで、タンパク質を修飾する糖鎖の構造がどのように決まるのかという謎に迫りました。
私達はこれまでに、血液凝固因子由来の10残基のアミノ酸配列を目的とする糖タンパク質につなげるだけで、その生産量を高められることを示し、本配列を「パスポート配列」として提唱してきました。糖鎖修飾は、分泌経路とくにゴルジ体を通過するときに形作られることが知られていることから、パスポート配列が糖鎖修飾に影響を与えるものとして予想し、本研究を実施しました。特に、パスポート配列とゴルジ体に存在するタンパク質や糖転移酵素との分泌経路中の出会いに着目することで、タンパク質を修飾する糖鎖の構造がどのように決まるのかという謎に迫りました。
研究成果
多くの分泌タンパク質や膜タンパク質は細胞内で糖鎖による修飾を受け、これはタンパク質の品質や機能を大きく左右します。私達のこれまでの研究により、パスポート配列がMCFD2/ERGIC-53受容体複合体[注2]に認識され、特定の糖タンパク質を効率的にゴルジ体へ輸送することが知られていましたが、どのようにゴルジ体内での糖鎖修飾に影響を与えるかは明らかにされていませんでした。
本研究では、このパスポート配列をエリスロポエチン(EPO)[注3]に付加することで、糖鎖のガラクトシル化[注4]とシアリル化[注5]という成熟化プロセスが促進されることを見出しました。また、近接依存性標識法[注6]を利用して、パスポート配列付加されたEPOは、ゴルジ体内で異なる分布をすること、またガラクトース糖転移酵素B4GALT1やNUCB1[注7]の近傍に存在することを明らかにしました。遺伝子抑制実験により、NUCB1がパスポート配列依存的なガラクトースやシアル酸を有する糖鎖の生合成を促す分子であることがわかりました。加えて、核磁気共鳴(NMR)法[注8]などによってNUCB1がパスポート配列と直接結合することが示され、パスポート配列がゴルジ体において糖転移酵素との相互作用を通じて、糖鎖修飾の効率を向上させる分子コードであることが明らかになりました。さらには、パスポート配列を付加したEPOはゴルジ体内の特定のゾーンにおいてB4GALT1やNUCB1と共存することが示唆され、これがパスポート配列依存的な糖鎖修飾の促進に関与する重要なメカニズムであることが分かりました。
以上、本研究では、パスポート配列が細胞内輸送を制御することで、糖タンパク質がゴルジ体内で糖転移酵素との相互作用が高まり、糖鎖修飾を効率よく行う仕組みを解明しました。
本研究では、このパスポート配列をエリスロポエチン(EPO)[注3]に付加することで、糖鎖のガラクトシル化[注4]とシアリル化[注5]という成熟化プロセスが促進されることを見出しました。また、近接依存性標識法[注6]を利用して、パスポート配列付加されたEPOは、ゴルジ体内で異なる分布をすること、またガラクトース糖転移酵素B4GALT1やNUCB1[注7]の近傍に存在することを明らかにしました。遺伝子抑制実験により、NUCB1がパスポート配列依存的なガラクトースやシアル酸を有する糖鎖の生合成を促す分子であることがわかりました。加えて、核磁気共鳴(NMR)法[注8]などによってNUCB1がパスポート配列と直接結合することが示され、パスポート配列がゴルジ体において糖転移酵素との相互作用を通じて、糖鎖修飾の効率を向上させる分子コードであることが明らかになりました。さらには、パスポート配列を付加したEPOはゴルジ体内の特定のゾーンにおいてB4GALT1やNUCB1と共存することが示唆され、これがパスポート配列依存的な糖鎖修飾の促進に関与する重要なメカニズムであることが分かりました。
以上、本研究では、パスポート配列が細胞内輸送を制御することで、糖タンパク質がゴルジ体内で糖転移酵素との相互作用が高まり、糖鎖修飾を効率よく行う仕組みを解明しました。
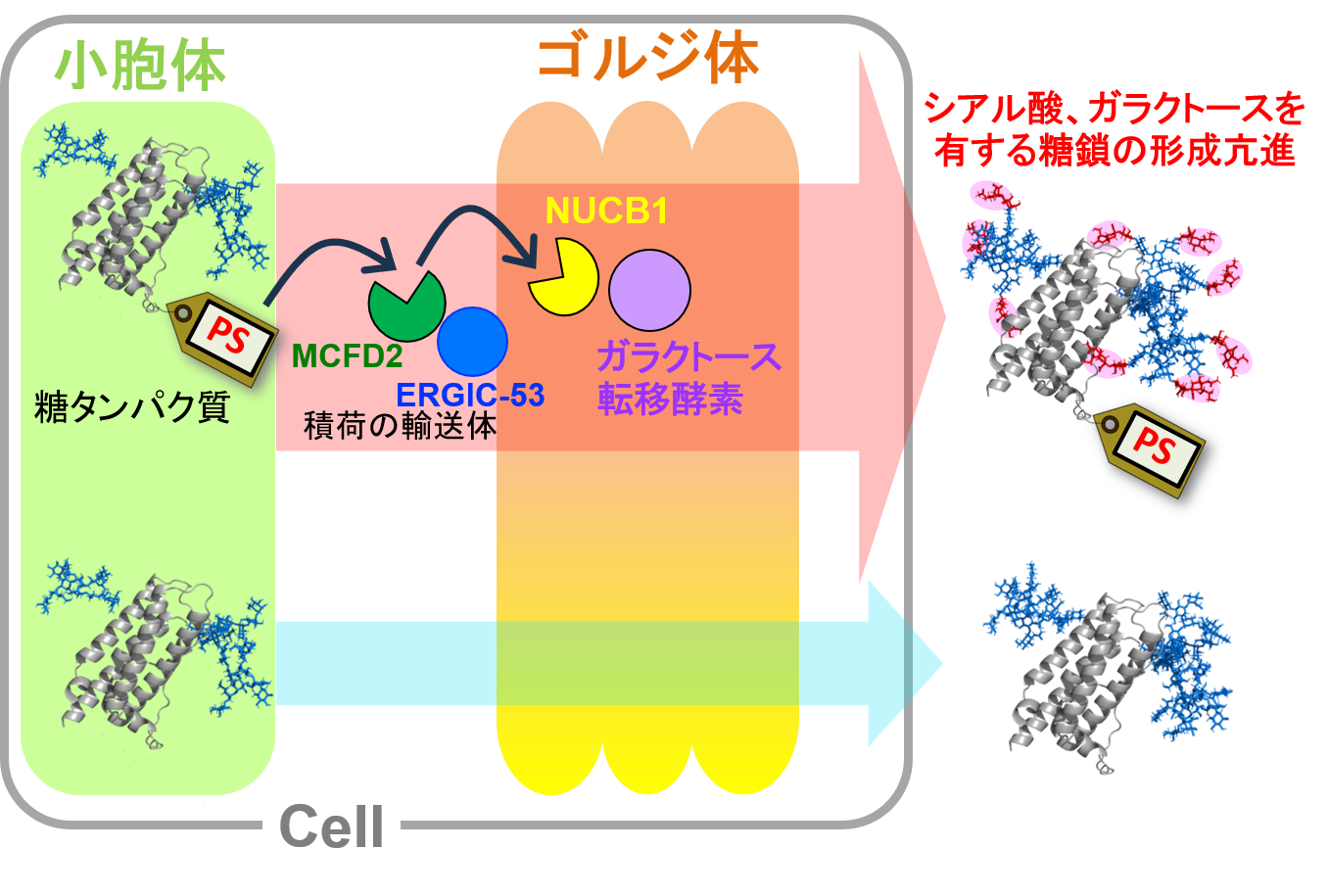
図1:パスポート配列(PS)を組み込んだ糖タンパク質は、積荷の輸送体に認識され、NUCB1に受け渡される。さらには、NUCB1の近傍に存在するガラクトース転移酵素によって、糖タンパク質糖鎖のガラクトース修飾、ひいてはシアル酸修飾が促されることを見出した。
成果の意義および今後の展開
本研究の成果は、バイオ医薬品の糖鎖修飾を制御するための新しい戦略を提供するものであり、高品質なバイオ医薬品の効率的な生産につながるものと期待されます。今後、様々なバイオ医薬品への応用が期待されており、創薬研究の進展に大きく貢献するものと考えられます。
用語解説
[注1]バイオ医薬品:遺伝子組換え技術や細胞培養技術を用いて、細胞やバクテリアなどにより産生されるタンパク質を有効成分とする医薬品。
[注2]MCFD2/ERGIC-53受容体複合体:血液凝固因子をはじめとする特異的な糖タンパク質の小胞体かゴルジ体の輸送を担うタンパク質複合体。パスポート配列を認識する。
[注3]エリスロポエチン:腎性貧血の治療に使われているバイオ医薬品。
[注4]ガラクトシル化:糖鎖にガラクトースが付加されること。
[注5]シアリル化:糖鎖にシアル酸が付加されること。
[注6]近接依存性標識法:着目するタンパク質の近くに存在する分子に目印をつける方法。ここでは、着目するFUT9をビオチンリガーゼと融合した状態で発現させることで、細胞内でFUT9近傍の分子のみをビオチンで標識した。その結果、糖鎖修飾コードを組み込んだ糖タンパク質が優先的にビオチン標識されることが示された。
[注7]NUCB1:ゴルジ体のカルシウム濃度を調節する分子として知られている。本研究で、パスポート配列と結合することは初めて見出した。
[注8]核磁気共鳴(NMR)法:タンパク質などを磁場の中に入れてラジオ波を照射することで核スピンの共鳴現象を観測し、分子構造を原子レベルで解析することができる。
[注2]MCFD2/ERGIC-53受容体複合体:血液凝固因子をはじめとする特異的な糖タンパク質の小胞体かゴルジ体の輸送を担うタンパク質複合体。パスポート配列を認識する。
[注3]エリスロポエチン:腎性貧血の治療に使われているバイオ医薬品。
[注4]ガラクトシル化:糖鎖にガラクトースが付加されること。
[注5]シアリル化:糖鎖にシアル酸が付加されること。
[注6]近接依存性標識法:着目するタンパク質の近くに存在する分子に目印をつける方法。ここでは、着目するFUT9をビオチンリガーゼと融合した状態で発現させることで、細胞内でFUT9近傍の分子のみをビオチンで標識した。その結果、糖鎖修飾コードを組み込んだ糖タンパク質が優先的にビオチン標識されることが示された。
[注7]NUCB1:ゴルジ体のカルシウム濃度を調節する分子として知られている。本研究で、パスポート配列と結合することは初めて見出した。
[注8]核磁気共鳴(NMR)法:タンパク質などを磁場の中に入れてラジオ波を照射することで核スピンの共鳴現象を観測し、分子構造を原子レベルで解析することができる。
研究グループ
本研究は、名古屋市立大学、生命創成探究センター、分子科学研究所、国立がん研究センター研究所、理化学研究所、名古屋大学糖鎖生命コア研究所が参加した共同研究です。
研究サポート
本研究は、JST-CREST (JPMJCR20E6,JPMJCR21E3), JST 創発的研究支援事業(JPMJFR2255), ヒューマングライコームプロジェクト、科学研究費補助金(JP22H02225, JP22K06213, JP17H06414, JP21H02625, JP20K21495, JP24H00599)等の支援を受けて実施されました。
掲載される論文の詳細
掲載誌:iScience
題目:Molecular tag for promoting N-glycan maturation in the cargo receptor-mediated secretion pathway
著者:矢木宏和(名古屋市立大学、生命創成探究センター)、山田梨乃(名古屋市立大学)、齋藤泰輝(名古屋市立大学、生命創成探究センター)、本田玲奈(名古屋市立大学、生命創成探究センター)、中野里音(名古屋市立大学)、犬塚健剛(名古屋市立大学)、立尾清悟(名古屋市立大学、生命創成探究センター)、草野秀夫(国立がん研究センター研究所)、西村久美子(国立がん研究センター研究所)、谷中冴子(名古屋市立大学、分子科学研究所、生命創成探究センター)、戸島拓郎(理化学研究所)、中野明彦(理化学研究所)、古川潤一(名古屋大学糖鎖生命コア研究所)、矢木真穂(名古屋市立大学、分子科学研究所、生命創成探究センター)、足達俊吾(国立がん研究センター研究所)、加藤晃一(名古屋市立大学、分子科学研究所、生命創成探究センター)
DOI:10.1016/j.isci.2024.111457
題目:Molecular tag for promoting N-glycan maturation in the cargo receptor-mediated secretion pathway
著者:矢木宏和(名古屋市立大学、生命創成探究センター)、山田梨乃(名古屋市立大学)、齋藤泰輝(名古屋市立大学、生命創成探究センター)、本田玲奈(名古屋市立大学、生命創成探究センター)、中野里音(名古屋市立大学)、犬塚健剛(名古屋市立大学)、立尾清悟(名古屋市立大学、生命創成探究センター)、草野秀夫(国立がん研究センター研究所)、西村久美子(国立がん研究センター研究所)、谷中冴子(名古屋市立大学、分子科学研究所、生命創成探究センター)、戸島拓郎(理化学研究所)、中野明彦(理化学研究所)、古川潤一(名古屋大学糖鎖生命コア研究所)、矢木真穂(名古屋市立大学、分子科学研究所、生命創成探究センター)、足達俊吾(国立がん研究センター研究所)、加藤晃一(名古屋市立大学、分子科学研究所、生命創成探究センター)
DOI:10.1016/j.isci.2024.111457

