タンパク質の小胞体における運命決定機構を解明 〜構造形成or分解 糖鎖を介したタンパク質の綱引き〜
神戸大学バイオシグナル総合研究センター 蜷川暁 助教(神戸大学大学院農学研究科 助教兼任)、松尾將生 同大学院生、京都大学大学院理学研究科 森和俊 教授(研究当時、現:高等研究院 特別教授)、鄧桜 同大学院生(研究当時)、自然科学研究機構 生命創成探究センター 加藤晃一 教授(名古屋市立大学大学院薬学研究科 特任教授・分子科学研究所 教授兼任)、名古屋市立大学大学院薬学研究科 矢木宏和 准教授 (生命創成探究センター 客員准教授兼任)らを中心とした研究グループは、タンパク質の構造形成を促す小胞体内糖付加酵素の機能を調べることによって、タンパク質の小胞体における運命が糖鎖(注1)を介した構造形成因子と分解因子の「綱引き」によって決定されることを明らかにしました。
この成果は、今、注目が集まっている第3の生命鎖である糖鎖を主な研究対象としており、分泌経路のタンパク質(例えば血中へ放出されるタンパク質や細胞表面などに出現する膜タンパク質)を作る小胞体の機能メカニズムへの深い理解につながります。小胞体は、アルツハイマー病、がん、糖尿病などのヒト疾患と密接に関わるため、本研究成果は、それらの新規治療戦略や予防法提案の礎となります。
この研究成果は、2024年12月10日に国際学術誌『eLife』に掲載されました。
この成果は、今、注目が集まっている第3の生命鎖である糖鎖を主な研究対象としており、分泌経路のタンパク質(例えば血中へ放出されるタンパク質や細胞表面などに出現する膜タンパク質)を作る小胞体の機能メカニズムへの深い理解につながります。小胞体は、アルツハイマー病、がん、糖尿病などのヒト疾患と密接に関わるため、本研究成果は、それらの新規治療戦略や予防法提案の礎となります。
この研究成果は、2024年12月10日に国際学術誌『eLife』に掲載されました。
ポイント
・従来の定説を覆し、小胞体の構造形成に関わる糖付加酵素UGGT1がタンパク質の分解を抑制することを世界で初めて明らかにした。
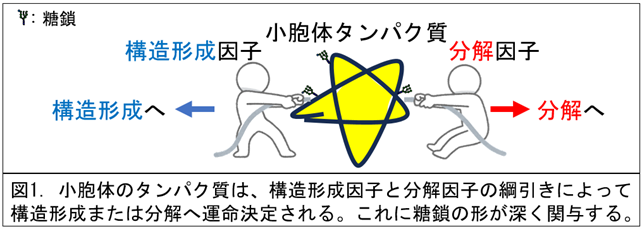
・糖鎖を介した構造形成因子と分解因子の綱引きによって、タンパク質の運命が決定されることを示した。
・糖鎖を介した構造形成因子と分解因子の綱引きによって、タンパク質の運命が決定されることを示した。
研究の背景
分泌経路のタンパク質群は、細胞膜で機能する膜タンパク質や、細胞外環境および血中へ分泌される分泌タンパク質からなり、アルツハイマー病、がん、糖尿病など数々のヒト疾患と密接に関わっています。膜タンパク質、分泌タンパク質群の機能としては、細胞間コミュニケーション、生体恒常性維持、免疫応答、消化、組織再生などを介して生体の機能維持を行うことが挙げられます。これらの分泌経路のタンパク質群の大元を作るのが細胞小器官のひとつである小胞体です。この小胞体の機能が破綻すると、分泌経路のタンパク質群がうまく作られなくなり、ヒト疾患の発症につながります。したがって、小胞体の作動原理を解明することは、種々の上記疾患に対する治療法、予防法の提案につながります。
小胞体では、全タンパク質の約1/3が生合成され、さらにその約80 %にN型糖鎖(注2)が付加されることによって糖鎖を介した、厳密なタンパク質の品質管理が行われています。つまり機能を発揮できる構造形成したタンパク質は小胞体から輸送され次の分泌経路へと進むのですが、機能を発揮できない構造異常タンパク質は分解処理されます。しかし、どのようにしてタンパク質が分泌経路へ向かうために構造形成が促進される方向に進むのか、もしくは構造形成を諦め分解処理されるように運命が決定づけられていくのか、が分かっておらず、小胞体分野の未解決な大問題として提示されていました。
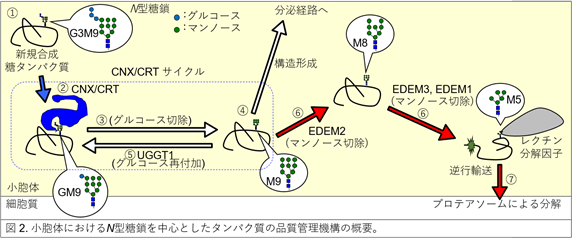
小胞体におけるタンパク質の構造形成や分解の経路は、N型糖鎖の有無によって大きく違います。N型糖鎖は3つのグルコース、9つのマンノースなど(G3M9と呼ぶ)からなる状態で、タンパク質に付加されます①(図2中)。そしてN型糖鎖の切除が進み、GM9になると、その構造を認識するレクチン(注3)分子シャペロンCNXもしくはCRTがタンパク質の構造形成を促します②。M9になり③構造形成していると次の分泌経路へと進むのですが④、構造形成していないとUGGT1によってグルコースが再付加されGM9となり⑤、再びレクチン分子シャペロンによって構造形成が促進されます。このグルコースの付加、除去に伴う構造形成サイクルをCNX/CRTサイクルと呼びます。一方でどうしても構造形成できない場合は、EDEM2によってN型糖鎖のマンノースが切除されM9→M8になり、さらにEDEM3またはEDEM1によってM8→M7、M6、M5へと切除されます⑥。すると、レクチン分解因子によって認識されるようになり、分解へと導かれていきます⑦。
小胞体では、全タンパク質の約1/3が生合成され、さらにその約80 %にN型糖鎖(注2)が付加されることによって糖鎖を介した、厳密なタンパク質の品質管理が行われています。つまり機能を発揮できる構造形成したタンパク質は小胞体から輸送され次の分泌経路へと進むのですが、機能を発揮できない構造異常タンパク質は分解処理されます。しかし、どのようにしてタンパク質が分泌経路へ向かうために構造形成が促進される方向に進むのか、もしくは構造形成を諦め分解処理されるように運命が決定づけられていくのか、が分かっておらず、小胞体分野の未解決な大問題として提示されていました。
小胞体におけるタンパク質の構造形成や分解の経路は、N型糖鎖の有無によって大きく違います。N型糖鎖は3つのグルコース、9つのマンノースなど(G3M9と呼ぶ)からなる状態で、タンパク質に付加されます①(図2中)。そしてN型糖鎖の切除が進み、GM9になると、その構造を認識するレクチン(注3)分子シャペロンCNXもしくはCRTがタンパク質の構造形成を促します②。M9になり③構造形成していると次の分泌経路へと進むのですが④、構造形成していないとUGGT1によってグルコースが再付加されGM9となり⑤、再びレクチン分子シャペロンによって構造形成が促進されます。このグルコースの付加、除去に伴う構造形成サイクルをCNX/CRTサイクルと呼びます。一方でどうしても構造形成できない場合は、EDEM2によってN型糖鎖のマンノースが切除されM9→M8になり、さらにEDEM3またはEDEM1によってM8→M7、M6、M5へと切除されます⑥。すると、レクチン分解因子によって認識されるようになり、分解へと導かれていきます⑦。
研究の内容
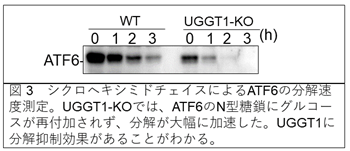
これまで小胞体の構造形成に関わる糖付加酵素UGGT1は、タンパク質の構造形成に寄与することが示されてきましたが、分解のタイミングには影響しないと提唱されていました(Tannous et al., 2015 MBoC)。本研究グループは、この説が複雑な実験によって示されていたため、完全には証明できていないことに気づき、より直接的にこれを検証するため、UGGT1の遺伝子破壊細胞(KO細胞)を作製し、調べました。すると、UGGT1-KO細胞ではWT細胞よりも、分解基質として用いたATF6の分解が劇的に加速することを見出しました(図3)。これにより、これまでの定説通りではなく、UGGT1が分解を抑制していることがわかりました。さらに他の分子の分解速度を調べると、構造が安定で半減期が長いタンパク質にはUGGT1は大きな影響を持たないのですが、構造が不完全であったり不安定なタンパク質に関してUGGT1が分解を抑制していることがわかりました。この分解抑制効果には、UGGT1の糖付加活性が必要でした。
これまでの研究成果と合わせて考えると、糖付加酵素であるUGGT1とマンノース切除酵素であるEDEM familyが基質を競合し、タンパク質の運命を構造形成に向かわせるか、分解に向かわせるかを決定しているという仮説が考えられます。そこで、小胞体構造形成因子や分解因子の遺伝子破壊や過剰発現法を用いて、基質の半減期の変化を追うと、構造形成因子や分解因子の量的バランスによって、構造形成に向かいやすいか分解に向かいやすいか決定されることが分かりました。すなわち、糖鎖を介した構造形成因子と分解因子の綱引きによって小胞体タンパク質の運命が決定されることを明らかにできました(図1参照)。
これまでの研究成果と合わせて考えると、糖付加酵素であるUGGT1とマンノース切除酵素であるEDEM familyが基質を競合し、タンパク質の運命を構造形成に向かわせるか、分解に向かわせるかを決定しているという仮説が考えられます。そこで、小胞体構造形成因子や分解因子の遺伝子破壊や過剰発現法を用いて、基質の半減期の変化を追うと、構造形成因子や分解因子の量的バランスによって、構造形成に向かいやすいか分解に向かいやすいか決定されることが分かりました。すなわち、糖鎖を介した構造形成因子と分解因子の綱引きによって小胞体タンパク質の運命が決定されることを明らかにできました(図1参照)。
今後の展開
小胞体の大問題のひとつとして挙げられていた、どのようにして生合成されたタンパク質が構造形成に向かうのか、分解に向かうのかという運命決定機構について糖鎖を介した大きな知見が本研究によって得られました。これは小胞体の基本的な作動メカニズムの根幹を形成し、小胞体の恒常性維持機構の理解に大きく貢献しています。小胞体の機能は、アルツハイマー病、がん、糖尿病などの60以上ものヒト疾患と関わることも分かっているため、さまざまなヒト疾患に対する新規治療戦略や予防法の提案の礎となります。また、UGGT1は、進化的に酵母では機能的に必要でないこともわかっているため、より高度化したヒトの小胞体機能の一端を担っていると考えられます。そして高等動物の生命活動の分子メカニズムの一部の理解が本研究によって大きく進みました。
用語解説
注1 糖鎖:第一の生命鎖は核酸、第二の生命鎖はアミノ酸、第三の生命鎖は糖鎖とされる。糖鎖は、各種の糖がグリコシド結合によって、鎖のようにつながりあった一群の化合物を指す。現在この第三の生命鎖の理解を深める日本での大きな流れとなるヒューマングライコームプロジェクトが動いている。
注2 N型糖鎖:小胞体を通過する80%程度のタンパク質を修飾する。これは、3つのグルコース、9つのマンノース、2つのN-アセチルグルコサミンからなり、タンパク質のアスパラギン(N)に結合する。
注3 レクチン:一定の構造を持つ糖鎖を識別し、結合するタンパク質の総称。
注2 N型糖鎖:小胞体を通過する80%程度のタンパク質を修飾する。これは、3つのグルコース、9つのマンノース、2つのN-アセチルグルコサミンからなり、タンパク質のアスパラギン(N)に結合する。
注3 レクチン:一定の構造を持つ糖鎖を識別し、結合するタンパク質の総称。
謝辞
本研究は、科研費(課題番号:18K06216、21H02625、23H03838、24H00599、17H01432、17H06419、22H00407)、JST戦略的創造研究推進事業 (CREST):JP MJCR21E3、JST創発的研究支援事業:JPMJFR2255、公益財団法人武田科学振興財団、公益財団法人小林財団、公益財団法人内藤記念科学振興財団、公益財団法人長瀬科学技術振興財団、三光舎、ExCELLS共同利用研究 (21-307)、J-GlycoNet (Support-18)の支援を受けて実施されました。
論文情報
・タイトル
“UGGT1-mediated reglucosylation of N-glycan competes with ER-associated degradation of unstable and misfolded glycoproteins”
DOI:10.7554/eLife.93117
・著者
蜷川 暁†*1, 2、松尾 將生†2、鄧 桜†3、大下 修一郎2、阿曽 伸哉2、松下 和俊3、谷口 麻衣3、笛木 茜2、山代 萌2、菅澤 薫1,4、斎藤 俊介3、今見 考志5、木塚 康彦6、佐久間 哲史7、山本 卓7、矢木 宏和8, 9、加藤 晃一8, 9, 10、森 和俊*3, 11
*Corresponding author †Co-1st author
1. 神戸大学バイオシグナル総合研究センター 2. 神戸大学大学院農学研究科 3. 京都大学大学院理学研究科 4. 神戸大学大学院理学研究科 5. 生命医科学研究センター 6. 岐阜大学糖鎖生命コア研究所 7. 広島大学大学院理学研究科 8. 名古屋市立大学大学院薬学研究科 9. 生命創成探究センター 10. 分子科学研究所 11. 京都大学高等研究院
・掲載誌
eLife
“UGGT1-mediated reglucosylation of N-glycan competes with ER-associated degradation of unstable and misfolded glycoproteins”
DOI:10.7554/eLife.93117
・著者
蜷川 暁†*1, 2、松尾 將生†2、鄧 桜†3、大下 修一郎2、阿曽 伸哉2、松下 和俊3、谷口 麻衣3、笛木 茜2、山代 萌2、菅澤 薫1,4、斎藤 俊介3、今見 考志5、木塚 康彦6、佐久間 哲史7、山本 卓7、矢木 宏和8, 9、加藤 晃一8, 9, 10、森 和俊*3, 11
*Corresponding author †Co-1st author
1. 神戸大学バイオシグナル総合研究センター 2. 神戸大学大学院農学研究科 3. 京都大学大学院理学研究科 4. 神戸大学大学院理学研究科 5. 生命医科学研究センター 6. 岐阜大学糖鎖生命コア研究所 7. 広島大学大学院理学研究科 8. 名古屋市立大学大学院薬学研究科 9. 生命創成探究センター 10. 分子科学研究所 11. 京都大学高等研究院
・掲載誌
eLife

