腎細胞がんに対する免疫チェックポイント阻害剤による重症の免疫関連有害事象(irAE)発症を予測するバイオマーカーを発見
研究成果の概要
名古屋市立大学大学院医学研究科の濵本 周造准教授(腎・泌尿器科学分野)と田﨑 慶彦研究員(臨床薬剤学分野)らの研究グループは、和歌山県立医科大学、神戸大学、徳島大学、近畿大学、奈良県立医科大学、和歌山医療センター、鳥取大学との多施設共同研究により、免疫チェックポイント阻害剤(注1)を投与した腎細胞がん患者において、好酸球(注2)の上昇が重症の免疫関連有害事象(irAE)発症リスクを約6倍増加させることを初めて発見しました。本研究成果は、irAEを早期に対処し重症化を防ぐことで、安全で継続的に免疫チェックポイント阻害剤を投与することにつながり、治療効果を最大限に高めることが期待されます。
研究のポイント
・免疫チェックポイント阻害剤を投与した腎細胞がん患者において、重症irAEを発症した患者の生存期間は、軽症irAEを発症した患者と比べ短くなる傾向にありました。
・治療開始から2週間後に好酸球が上昇した患者は、重症irAEを発症するリスクが約6倍高くなることがわかりました。
・免疫チェックポイント阻害剤を受けた腎細胞がん患者において、好酸球の増加が重症irAEの発症を予測するバイオマーカーとなることが期待されます。
・治療開始から2週間後に好酸球が上昇した患者は、重症irAEを発症するリスクが約6倍高くなることがわかりました。
・免疫チェックポイント阻害剤を受けた腎細胞がん患者において、好酸球の増加が重症irAEの発症を予測するバイオマーカーとなることが期待されます。
背景
免疫チェックポイント阻害剤は、がんに対する治療戦略を劇的に変化させました。中でも、腎細胞がんは免疫チェックポイント阻害剤の治療効果の恩恵を受けたがんの1つです。これまで有効な治療法が確立されていなかった腎細胞がんに対して、免疫チェックポイント阻害剤は生存期間を改善させる画期的な治療となりました。一方で、免疫チェックポイント阻害剤は全身の臓器に対して免疫関連有害事象(irAE)を引き起こします。大規模な臨床試験において、免疫チェックポイント阻害剤を受けた腎細胞がん患者の約90%がirAEを発症し、46%の患者が重症irAEを発症したことが報告されました。免疫チェックポイント阻害剤を受けた腎細胞がん患者で重症irAEの発症率が高いことが問題となっています。
irAEは免疫賦活に伴う非特異的な免疫反応です。その特性上、irAEが「いつ」、「どの」臓器で発生するかを予測することは困難であり、現在まで、irAEの発症を予測・予防する方法は確立されていません。irAEの重症化を防ぐためには、患者自身がirAEの多種多様な症状をセルフモニタリングし、症状を医療者に申告する必要があります。そして、重症irAEを発症した場合は、治療効果が得られていたとしても治療を中止し免疫抑制剤を投与するしか方法がありません。重症irAEが発症することにより、患者の生存期間へ悪影響を及ぼす可能性があります。そのため、重症irAEの発症率が高い腎細胞がんで、重症irAEの発症を予測するためのバイオマーカーを確立する必要があります。そこで本研究では、好酸球が重症irAEの発症を予測するバイオマーカーとなるか検討しました。
irAEは免疫賦活に伴う非特異的な免疫反応です。その特性上、irAEが「いつ」、「どの」臓器で発生するかを予測することは困難であり、現在まで、irAEの発症を予測・予防する方法は確立されていません。irAEの重症化を防ぐためには、患者自身がirAEの多種多様な症状をセルフモニタリングし、症状を医療者に申告する必要があります。そして、重症irAEを発症した場合は、治療効果が得られていたとしても治療を中止し免疫抑制剤を投与するしか方法がありません。重症irAEが発症することにより、患者の生存期間へ悪影響を及ぼす可能性があります。そのため、重症irAEの発症率が高い腎細胞がんで、重症irAEの発症を予測するためのバイオマーカーを確立する必要があります。そこで本研究では、好酸球が重症irAEの発症を予測するバイオマーカーとなるか検討しました。
研究の成果
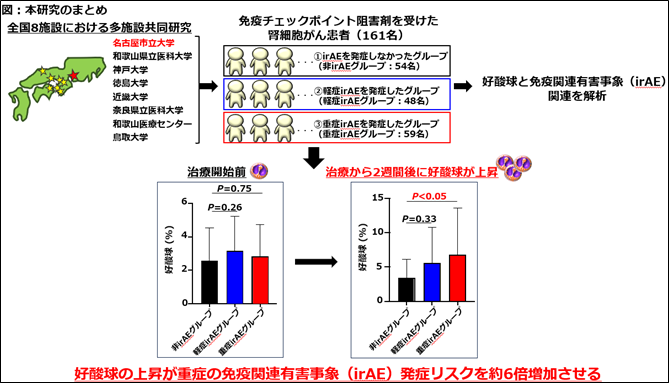
研究グループは、161名の免疫チェックポイント阻害剤を受けた腎細胞がん患者をirAEの重症度に基づいて、①irAEを発症しなかったグループ(非irAEグループ:54名)②軽症irAEを発症したグループ(軽症irAEグループ:48名)③重症irAEを発症したグループ(重症irAEグループ:59名)の3 つのグループに分けました。
まず初めに、3つのグループの生存期間を調べました。その結果、非irAEグループ(黒線)は、軽症irAEグループ(青線)と重症irAEグループ(赤線)に比べ最も生存期間が短いことがわかりました(図1)。さらに、重症irAEグループ(赤線)は軽症irAEグループ(青線)と比べ、生存期間が短くなる傾向にあることもわかりました(図1)。
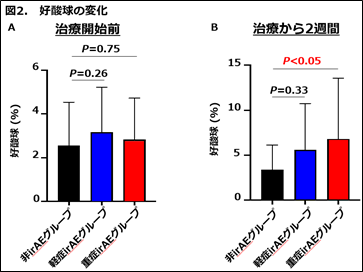
次に、免疫チェックポイント阻害剤による治療開始前と治療から2週間経過した時点の好酸球の変動を調べました。その結果、治療開始前の好酸球は、非irAEグループ(黒)、軽症irAEグループ(青)と重症irAEグループ(赤)との間で変化はありませんでした(図2A)。免疫チェックポイント阻害剤による治療から2週間経過した時点の好酸球は、非irAEグループ(黒)と比べて重症irAEグループ(赤)で上昇していることがわかりました(図2B)。
最後に、重症irAEの発症に対する好酸球の最適なカットオフ値の算出を行いました。その結果、好酸球の最適なカットオフ値は3.0%でした。そして、多変量ロジスティック回帰分析では、免疫チェックポイント阻害剤による治療から2週間後に好酸球が3.0%を超えて上昇した腎細胞がん患者において、重症irAEの発症リスクが約6.0倍上昇することがわかりました。
本研究から、免疫チェックポイント阻害剤を受けた腎細胞がん患者において好酸球の増加が、重症irAEの発症を予測するバイオマーカーとなる可能性を初めて見出すことができました。本研究成果は、生存期間に負の影響を与える重症irAE の発症を早期に発見し安全に免疫チェックポイント阻害剤を継続するために、好酸球の変動をモニタリングすることの重要性について新たな根拠を提供します。
まず初めに、3つのグループの生存期間を調べました。その結果、非irAEグループ(黒線)は、軽症irAEグループ(青線)と重症irAEグループ(赤線)に比べ最も生存期間が短いことがわかりました(図1)。さらに、重症irAEグループ(赤線)は軽症irAEグループ(青線)と比べ、生存期間が短くなる傾向にあることもわかりました(図1)。
次に、免疫チェックポイント阻害剤による治療開始前と治療から2週間経過した時点の好酸球の変動を調べました。その結果、治療開始前の好酸球は、非irAEグループ(黒)、軽症irAEグループ(青)と重症irAEグループ(赤)との間で変化はありませんでした(図2A)。免疫チェックポイント阻害剤による治療から2週間経過した時点の好酸球は、非irAEグループ(黒)と比べて重症irAEグループ(赤)で上昇していることがわかりました(図2B)。
最後に、重症irAEの発症に対する好酸球の最適なカットオフ値の算出を行いました。その結果、好酸球の最適なカットオフ値は3.0%でした。そして、多変量ロジスティック回帰分析では、免疫チェックポイント阻害剤による治療から2週間後に好酸球が3.0%を超えて上昇した腎細胞がん患者において、重症irAEの発症リスクが約6.0倍上昇することがわかりました。
本研究から、免疫チェックポイント阻害剤を受けた腎細胞がん患者において好酸球の増加が、重症irAEの発症を予測するバイオマーカーとなる可能性を初めて見出すことができました。本研究成果は、生存期間に負の影響を与える重症irAE の発症を早期に発見し安全に免疫チェックポイント阻害剤を継続するために、好酸球の変動をモニタリングすることの重要性について新たな根拠を提供します。

研究の意義と今後の展開や社会的意義など
近年、免疫チェックポイント阻害剤が保険適応となるがん種は拡大し続けており、多くの診療科で治療を行っています。そのため本研究の成果は、多くの診療科や臨床現場に応用できる可能性を秘めています。
現在までに、好酸球がどのようにirAE発症に関与しているか詳細なメカニズムはわかっていません。そのため、研究グループはirAE発症メカニズムの解明を目指した基礎研究を行っています。最終的には、好酸球を標的としたirAE発症を予防する新規治療薬の創出を目指しています。
現在までに、好酸球がどのようにirAE発症に関与しているか詳細なメカニズムはわかっていません。そのため、研究グループはirAE発症メカニズムの解明を目指した基礎研究を行っています。最終的には、好酸球を標的としたirAE発症を予防する新規治療薬の創出を目指しています。
用語解説
注1 免疫チェックポイント阻害剤:がん細胞が免疫細胞の攻撃を逃れる「ブレーキ」を解除して、免疫細胞によるがん細胞の攻撃を回復させる治療薬です。
注2 好酸球:白血球の一種で、免疫系の細胞として異物から身体を守る役割を担っています。アレルギー反応や喘息、寄生虫感染などの際に増加し、炎症の制御にも関与しています。
注2 好酸球:白血球の一種で、免疫系の細胞として異物から身体を守る役割を担っています。アレルギー反応や喘息、寄生虫感染などの際に増加し、炎症の制御にも関与しています。
著者
田﨑 慶彦1, 濵本 周造2* (Corresponding author), 山下 真平3, 古川 順也4, 藤田 和利5, 冨田 諒太郎4, 三宅 牧人6, 伊藤 哲之7, 岩本 秀人8, 三村 佳久1, 杉山 洋介1, 海野 怜2, 岡田 淳志2, 安井 孝周2, 日比 陽子1
所属
1名古屋市立大学大学院 医学研究科 臨床薬剤学分野
2名古屋市立大学大学院 医学研究科 腎・泌尿器科学分野
3和歌山県立医科大学 医学部 泌尿器科
4徳島大学大学院 医歯薬学研究部 泌尿器科学分野
5近畿大学 医学部 泌尿器科学
6奈良県立医科大学 医学部 泌尿器科
7日本赤十字社 和歌山医療センター 泌尿器科
8鳥取大学医学部 器官制御外科学講座 腎泌尿器学分野
所属
1名古屋市立大学大学院 医学研究科 臨床薬剤学分野
2名古屋市立大学大学院 医学研究科 腎・泌尿器科学分野
3和歌山県立医科大学 医学部 泌尿器科
4徳島大学大学院 医歯薬学研究部 泌尿器科学分野
5近畿大学 医学部 泌尿器科学
6奈良県立医科大学 医学部 泌尿器科
7日本赤十字社 和歌山医療センター 泌尿器科
8鳥取大学医学部 器官制御外科学講座 腎泌尿器学分野
掲載学術誌
学術誌名 Frontiers in Immunology
DOI番号:10.3389/fimmu.2024.1483956
DOI番号:10.3389/fimmu.2024.1483956
